Versorgung mit Biologika: Original oder Biosimilar?
>> Im Herbst dieses Jahres verliert der monoklonale Antikörper Adalimumab in Deutschland den Patentschutz. Mit einem Umsatz von 1,04 Mrd. Euro (nach AVP) ist das Biologikum nicht nur in 2017 sondern auch in den beiden Vorjahren der umsatzstärkste Wirkstoff in der GKV. Die Verordnungen von Adalimumab sind von 2015 auf 2017 um knapp 11 Prozent angestiegen (Quelle: regioMA, INSIGHT Health). Der zur Gruppe der TNF-alpha-Inhibitoren gehörende Antikörper wird zur Therapie von Erkrankungen, die mit hochregulierten inflammatorischen Prozessen des Körpers assoziiert sind, eingesetzt. Darunter beispielsweise die Rheumatoide Arthritis, chronisch entzündliche Darmerkrankungen und Psoriasis. Das breite Indikationsspektrum ist eine Therapieoption für zahlreiche Patienten, die Biosimilar-Hersteller schon Jahre vor dem Patentablauf als Potenzial erkannt haben. Bereits jetzt sind vier Biosimilars der Hersteller Amgen, Boehringer und Samsung zugelassen (Quelle: public assessment reports der EMA; Stand 16.03.2018).
Dass direkt mit Patentablauf Biosimilars für die Versorgung zur Verfügung stehen werden, lenkt die Diskussion unweigerlich auf die Möglichkeiten bzw. Grenzen der Umstellung von Patienten vom Original auf die neuen Arzneimittel. Aber vor allem Neueinstellungen können bevorzugt auf die dann verfügbaren Biosimilars erfolgen. Obschon Adalimumab aufgrund des breiten Indikationsspektrums und dem hohen Umsatzpotenzial eine besondere Bedeutung zukommt, ist der Markteintritt von Biosimilars bei den TNF-alpha-Inhibitoren keine neue Situation mehr. Anhand der beiden Biologika Etanercept und Infliximab lassen sich einige Mechanismen aufzeigen. Auch der zur Krebstherapie eingesetzte monoklonale Antikörper Rituximab, für den mit Truxima und Rixathon zwei Biosimilars auf dem deutschen Markt verfügbar sind, wird hinsichtlich der Patientendynamik betrachtet. Dafür wird das Panel Patient INSIGHTS von INSIGHT Health verwendet, das mit mehr als 47 Millionen Patienten, die seit 2013 zur Verfügung stehen, die Darstellung der Medikationshistorie von anonymisierten GKV-Versicherten ermöglicht.
Steigende Patientenzahlen für Benepali
Im Februar 2016 bekam im Etanercept-Markt das Original Enbrel mit Benepali eine erste Biosimilar-Konkurrenz; im Juli 2017 folgte dann mit Erelzi das zweite und bis dato letzte Biosimilar. Seit dem Markteintritt der Biosimilars lässt sich eine merkliche Marktausweitung beobachten: So steigt die Anzahl der Patienten bis zum Januar 2018 von 10.000 auf über 12.000 an. Waren im März 2016 noch fast alle Patienten auf das Original Enbrel und erst 36 auf Benepali eingestellt, zeigt sich im Januar 2018 folgendes Bild: Noch 6.725 Patienten erhalten Enbrel, 5.260 Benepali und 797 Patienten sind auf Erelzi eingestellt (vgl. Abb. 1). Somit machen die Biosimilars nach 22 Monaten schon fast die Hälfte des Etanercept-Marktes aus. Das erste Etanercept-Biosimilar hat sich damit manifest in der Versorgung der Patienten etabliert. Inwieweit dieser Umstand auch auf Erelzi zutrifft, bleibt weiter zu beobachten. Aufgrund des Kostendrucks in der GKV ist die Verordnung von Biosimilars etablierter Bestandteil zahlreicher verordnungssteuernder Maßnahmen. Die Betrachtung von Neueinstellungs- und Umstellungszahlen der Patienten vermittelt einen guten Eindruck der Auswirkungen dieser Vorgaben. So übersteigt erstmals im Oktober 2016 die Anzahl der neu auf Benepali eingestellten Patienten mit 563 die der auf Enbrel neu eingestellten (527). In den folgenden Monaten erhalten zunehmend mehr Patienten erstmalig Benepali, wobei sich dieser Wert in den letzten Monaten des Jahres 2017 auf ca. 900 monatliche Neupatienten einpendelt.
Die Anzahl der neu auf das Originalpräparat Enbrel eingestellten Patienten sank im Betrachtungszeitraum kontinuierlich von 843 im März 2016 auf 222 im ersten Monat des Jahres 2018. Da gleichzeitig monatlich die Anzahl der Umstellungen von Enbrel auf Benepali nur ca. ein Viertel der Anzahl der Neueinstellungen erreicht, sind die Neueinstellungen der Haupttreiber der Biosimilar-Ausweitung. Die Empfehlung insbesondere bei einer Erstverordnung ein Biosimilar zu wählen, scheinen die Ärzte demnach bei der Therapie mit Etanercept zu berücksichtigen. Anders zeigt sich die Situation bei dem seit Juli 2017 im Markt befindlichen Biosimilar Erelzi. Hier haben Therapieumstellungen eine relativ höhere Bedeutung als beim Erstbiosimilar. So sind im Januar des aktuellen Jahres 254 therapienaive Patienten auf Erelzi eingestellt und 161 bereits mit Etanercept therapierte Patienten darauf umgestellt. Wie sich die Patientenzahlen bei Verfügbarkeit von Biosimilars weiter verschieben und welches Präparat die Patienten letztlich erhalten, bleibt weiter spannend zu beobachten. Dass grundsätzlich aber zunehmend mehr Patienten Etanercept erhalten verwundert aufgrund der allgemein zunehmenden Verordnungen von Biologika nicht.
Infliximab-Original dominiert lange
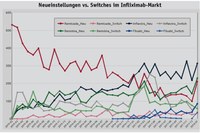
Wie bereits für Etanercept gezeigt, weitet sich auch der Markt für Infliximab aus und zwar innerhalb von 3 Jahren von monatlich 5.500 Patienten auf monatlich fast 10.000 Patienten. Dabei blieb die Anzahl der auf das Original Remicade eingestellten Patienten über einen Zeitraum von 2 Jahren nach Markteintritt der ersten beiden Biosimilars im Februar 2015 konstant. Ab dem 3. Quartal 2017 sank dieser Wert von über 5.000 Patienten auf ca. 4.000 Patienten pro Monat. Zu diesem Zeitpunkt übersprang die Anzahl der auf das Biosimilar Inflectra eingestellten Patienten die 2.000er-Schwelle und steigerte sich bis zum Januar 2018 auf ca. 3.300 Patienten. Die Entwicklung des parallel verfügbaren Biosimilars Remsina verlief anfangs merklich weniger dynamisch. Das dritte Biosimilar Flixabi ist seit Januar 2017 verfügbar und spielt bislang keine große Rolle im Infliximab-Markt. Im Januar 2018 sind 364 Patienten in Therapie. Wie Abbildung 2 verdeutlicht, zeigt sich diese Dynamik zugunsten der Biosimilars auch an den Neueinstellungen: Im Januar 2018 wurden noch 210 von ehemals über 530 Patienten auf das Original Remicade eingestellt. Dagegen schon 313 auf Inflectra, 230 auf Remsima und 86 auf Flixabi. Die Umstellungsdynamik dieses Marktes zugunsten der Bio-similars speist sich somit ganz wesentlich, wie erwartet, aus bisher therapienaiven Patienten und deutlich weniger aus Switches innerhalb der Substanz Infliximab. Wie bei Etanercept erfolgt auch bei Infliximab nach dem Biosimilareintritt eine deutliche Marktausweitung, jedoch konnte das Originalpräparat Remicade hier sehr lange seine Patientenzahl halten.
Neueinstellungen vs. Switches
Im Rituximab-Markt ist nach dem Markteintritt der Biosimilars in 2017 noch keine merkliche Ausweitung erkennbar. Zwischen dem Original Mabthera und den beiden Biosimilars Truxima und Rixanthon zeigt sich bislang ein reiner Verdrängungswettbewerb. Die Gesamtzahl der auf die Substanz Rituximab eingestellten Patienten stagniert bei einem Monatswert von etwa 6.000. Das Original Mabthera verliert zurzeit monatlich ca. 300 Patienten an die Biosimilars, wobei das zuerst eingeführte Truxima lange den überwiegenden Teil davon für sich gewinnen konnte. Mit Januar 2018 jedoch teilen sich die Patienten mit Biosimilar-Verordnung je zur Hälfte auf die beiden Nachahmer-Produkte auf.
Dabei beruhen die Gewinne von Truxima in den ersten 6 Monaten nach Markteinführung zu einem Großteil auf Therapieumstellungen und erst in den letzten 3 Monaten stärker auf Verordnungen an bislang therapienaive Patienten. Bei Rixanthon, das seit Juli 2017 auf dem deutschen Markt verfügbar ist, halten sich Neueinstellungen und Umstellungen im Betrachtungszeitraum in etwa die Waage. So verteilen sich bei Truxima die neu gewonnenen Patienten im Januar 2018 auf 425 Therapieneueinstellungen und 238 Umstellungen. Bei Rixanthon hingegen überwiegt in diesem Monat die Zahl der Umstellungen die der Neueinstellungen (164 vs. 146 Patienten). Parallel dazu verzeichnet das Original Mabthera 497 Therapieneueinstellungen und lediglich 27 Umstellungen. Somit zeigen sich im ersten onkologischen Biosimilar-Markt durchaus andere Entwicklungen als beispielsweise in diversen Rheuma-Märkten.
Fazit
Beide im Bereich der rheumatologischen Therapeutika und anderer Autoimmunerkrankungen betrachteten Märkte (Etanercept, Infliximab) zeigen nach Biosimilareintritt eine deutliche Ausweitung. Daraus lässt sich die Prognose ableiten, dass nach Patentablauf von Adalimumab und dem Markteintritt von Biosimilars ebenfalls eine signifikante Marktausweitung statt eines reinen Verteilungswettbewerbs zu erwarten ist. Dies gilt so mit hoher Wahrscheinlichkeit auch für weitere Produkte in diesen Therapiefeldern. Die Ergebnisse der Analysen decken sich mit der Meinung zahlreicher medizinischer Experten, die für viele bislang konservativ behandelte Patienten aus dem rheumatischen Formenkreis in einer Biologika-Therapie noch einen erheblichen Benefit sehen und damit mehr Patienten einer solchen Behandlung zuführen. Umgekehrt zeigt der erste Biosimilar-Markteintritt bei Onkologika (Rituximab), dass in diesen Märkten eher ein harter Verdrängungswettbewerb denn eine Markterweiterungen stattfinden wird. Denn Tumorpatienten erhalten schon jetzt weitgehend eine Leitlinien-gerechte Therapie und damit auch, wenn indiziert, Biologika. Bislang konnten die Originalanbieter in biosimilarfähigen Märkten noch über einen Zeitraum von bis zu zwei Jahren ihre Patienten halten, dies ist sicherlich auch der geringen Anzahl der jeweils verfügbaren Biosimilars geschuldet. Zudem war bislang bei den Therapieentscheidern eine sehr große Zurückhaltung bei Umstellungen vom Original auf Biosimilar festzustellen. Dies scheint sich seit dem Jahre 2017 merklich zu verändern, denn nun tragen auch Umstellungen verstärkt zum Marktanteilsgewinn der Biosimilars bei. Hier deutet sich ein Erfolg der Kampagnen von KVen und Biosimilarherstellern an, die Biosimilars als günstigere Variante einer medizinisch identischen Therapie darstellen.
Spannend bleibt, inwieweit die KVen in ihren Verordnungsrichtlinien den Einsatz von Biosimilars weiter zu befördern versuchen. Parallel dazu werden die Kostenträger gerade in Märkten mit mehreren Biosimilaranbietern versuchen, über Open House- bzw. exklusive Rabattverträge die Therapiekosten zu reduzieren. Die „Komfortzone“, in der sich viele Originalanbieter von Biologika auch nach Patentablauf noch längere Zeit bewegen konnten, wird sich in Zukunft absehbar verkürzen und verengen. <<
Autoren: Dr. Hans-Jürgen Schweyda und
Kathrin Pieloth*
Zitationshinweis : Schweyda, H.-J., Pieloth, K.: „Versorgung mit Biologika: Original oder Biosimilar?“, in: „Monitor Versorgungsforschung“ (02/18), S. 12-13; doi: 10.24945/MVF.02.18.1866-0533.2069