Änderungen der zweckmäßigen Vergleichstherapie
http://doi.org/10.24945/MVF.05.22.1866-0533.2440
>> Die zVT wird vom G-BA festgelegt nach Maßstäben, die sich aus seiner Verfahrensordnung (VerfO) ergeben. Die Basis hierfür ist wiederum § 35a SGB V in Verbindung mit § 6 AM-NutzenV. Demnach ist die zVT regelhaft zu bestimmen nach Maßstäben, die sich aus den internationalen Standards der evidenzbasierten Medizin ergeben. Sie muss eine nach dem allgemein anerkannten Stand der medizinischen Erkenntnisse zweckmäßige Therapie im Anwendungsgebiet sein, vorzugsweise eine Therapie, für die Endpunktstudien vorliegen und die sich in der praktischen Anwendung bewährt hat, soweit nicht Richtlinien nach § 92 Abs. 1 des SGB V oder das Wirtschaftlichkeitsgebot dagegensprechen. Sind mehrere Alternativen für die Vergleichstherapie gleichermaßen zweckmäßig, kann der Zusatznutzen gegenüber jeder dieser Therapien nachgewiesen werden. Für Arzneimittel einer Wirkstoffklasse ist dabei die gleiche zweckmäßige Vergleichstherapie heranzuziehen, um eine einheitliche Bewertung zu gewährleisten.
Bei der Bestimmung der zweckmäßigen Vergleichstherapie sind nach der VerfO des G-BA insbesondere folgende Kriterien zu berücksichtigen:
1. Sofern als Vergleichstherapie eine Arzneimittelanwendung in Betracht kommt, muss das Arzneimittel grundsätzlich eine Zulassung für das Anwendungsgebiet haben.
2. Sofern als Vergleichstherapie eine nichtmedikamentöse Behandlung in Betracht kommt, muss diese im Rahmen der gesetzlichen Krankenversicherung erbringbar sein.
3. Als Vergleichstherapie sollen bevorzugt Arzneimittelanwendungen oder nichtmedikamentöse Behandlungen herangezogen werden, deren patientenrelevanter Nutzen durch den Gemeinsamen Bundesausschuss bereits festgestellt ist.
4. Die Vergleichstherapie soll nach dem allgemein anerkannten Stand der medizinischen Erkenntnisse zur zweckmäßigen Therapie im Anwendungsgebiet gehören.
Mit der Veröffentlichung der Nutzenbewertung, also drei Monate nach dem Beginn eines Verfahrens veröffentlicht der G-BA einige „Informationen zur zweckmäßigen Vergleichstherapie“. Dazu gehört die Aufzählung der zugelassenen Arzneimittel, die Beschreibung der Recherchestrategie sowie die Ergebnisse der Recherche als eine tabellarische Darstellung der Inhalte der relevanten Publikationen. Die eigentlichen Entscheidungsgrundlagen (die tragenden Gründe) der o.g. Kriterien bei der Festlegung der zVT werden nachträglich erst mit dem Beschluss, also sechs Monate nach Verfahrensbeginn veröffentlicht.
G-BA-Beratung
Zu der festzulegenden zVT kann sich das betroffene pharmazeutische Unternehmen vom G-BA beraten lassen. Über das Beratungsgespräch erhält der pharmazeutische Unternehmer eine Niederschrift. Die vom G-BA im Rahmen einer Beratung erteilten Auskünfte sind jedoch laut 5. Kapitel § 7 VerfO nicht verbindlich. Das heißt, der G-BA kann die mitgeteilte zVT zu einem späteren Zeitpunkt verändern.
Für die Beratung erhebt der G-BA Gebühren, die vom pharmazeutischen Unternehmen zu zahlen sind. Gemäß der aktuellen Gebührenordnung fallen solche Beratungen regelhaft in die Kategorie III und kosten je 16.000 Euro.
Die Beratungen sollen gemäß der VerfO innerhalb von acht Wochen nach Einreichen der Unterlagen durchgeführt werden. Diese Frist wird nach den Erfahrungen der Industrie nicht immer eingehalten. Zugleich ist das Einreichen der Unterlagen nicht jederzeit möglich, sondern an einen Beratungstermin geknüpft, der im Voraus zu buchen ist. In der jüngeren Vergangenheit waren solche Beratungstermine erst 5 bis 9 Monate im Voraus verfügbar. Effektiv waren also Beratungsgespräche zur zVT erst in 7 bis 11 Monaten möglich, wie sich dies in der Darstellung der verfügbaren Termine auf der Webseite des G-BA während des Jahres 2022 nachvollziehen ließ (G-BA 2022b). In Ausnahmefällen bestand jedoch die Möglichkeit eines früheren Termins zur Einreichung der Unterlagen.
Die Beratung zur Festlegung einer zVT lässt sich dabei grundsätzlich nach zwei Zweckbestimmungen unterscheiden:
• zur Planung von pivotalen, klinischen Studien
oder
• vor der Einreichung eines Dossiers zur Nutzenbewertung.
Bei Beratungen zur zVT vor Beginn von pivotalen Zulassungsstudien können unter Beteiligung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) oder des Paul-Ehrlich-Instituts (PEI) stattfinden. Insbesondere bei Beratungen zur zVT sollen zudem nach § 35a Abs. 7 SGB V die wissenschaftlich-medizinischen Fachgesellschaften und die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) schriftlich beteiligt werden.
Arten der zweckmäßigen Vergleichstherapie
Grob lassen sich die vorgegebenen zVT in fünf Kategorien zusammenfassen:
(1) Eine Therapie mit der Vorgabe einer einzigen Therapieoption.
(2) Mehrere alternative Therapien, die im Sinne einer oder-Verknüpfung als gleichermaßen zweckmäßige Optionen dienen und in einer Single-Komparator-Studie untersucht werden können.
(3) Eine patientenindividuelle Therapie nach Maßgabe/Wahl des Arztes mit mehreren Therapieoptionen. Bei der Umsetzung sind hier im Vergleich zu o. g. Kategorien grundsätzlich Multi-Komparator-Studien mit einer Dokumentation der individuellen Therapieentscheidung erforderlich, wobei in bestimmten Fällen auch Single-Komparator-Studien (z. B. Bildung durch die Bildung von Patientengruppen) berücksichtigt werden können.
(4) Eine Therapie nach Maßgabe/Wahl des Arztes. Diese Option wird in solchen Fällen festgelegt, wenn relevante Diskrepanzen zwischen zugelassenen und in der Versorgung relevanten bzw. in Leitlinien empfohlenen Arzneimitteln bestehen. Eine Therapie nach Maßgabe des Arztes beinhaltet damit im Vergleich zu den o.g. Kategorien auch die nicht regelhaft verordnungsfähigen Off-Label-Therapien. Hier sind sowohl Vorgaben zu Single-Komparator- wie auch zu Multiple-Komparator-Studien möglich.
(5) Best-Supportive-Care (BSC), wenn es keine relevanten therapeutischen Alternativen gibt und daher ein patientenindividueller Ansatz im Sinne einer optimierten, unterstützenden Behandlung angebracht ist.
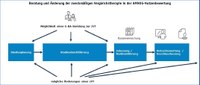
Änderung der zweckmäßigen Vergleichstherapie
Inhaltliche Begründung
Die vom G-BA festgelegte zVT ist nicht verbindlich und kann zu einem späteren Zeitpunkt verändert werden. Der Bedarf einer Anpassung kann zum einen durch eine Änderung des Anwendungsgebietes eines Arzneimittels im Studien- oder im Zulassungsprozess resultieren. Zum anderen kann sich die Erforderlichkeit der Änderung durch eine entsprechende Weiterentwicklung des Stands der medizinischen Erkenntnisse und der Versorgungsrelevanz in der Praxis ergeben. Dies kann sich beispielsweise in den veränderten Empfehlungen der klinischen Leitlinien der medizinischen Fachgesellschaften widerspiegeln. Zugleich können diese Erkenntnisse auch im Laufe des Verfahrens im Rahmen des schriftlichen und mündlichen Stellungnahmeverfahrens deutlich werden. Ein weiterer Faktor für die Änderung kann aus den G-BA-Beschlüssen selbst resultieren, wenn bewertete Arzneimittel mit oder ohne belegten Zusatznutzen als neue Vergleichstherapien (oder als Teil davon) ausgewiesen werden. Hinsichtlich der inhaltlichen Begründung besteht jedoch keine klar vorgegebene Systematik oder erst recht kein Algorithmus, vielmehr ist es eine Abwägungsentscheidung des G-BA, ob und aus welchen Gründen er eine Änderung der zVT veranlasst.
Eine Änderung der zVT kann zu einer beliebigen Zeit stattfinden, so z. B. bereits einige Monate nach einer G-BA-Beratung bzw. während einer bereits laufenden Studie mit dem beratenen Komparator. Teils können in dieser Zeit auch mehrere Anpassungen seitens des G-BA vorgenommen werden (G-BA 2018). Eine Änderung ist auch unmittelbar (also wenige Wochen wie im Verfahren zum Wirkstoff Ertugliflozin) vor der Dossiereinreichung möglich (G-BA 2022). Ebenso kann der G-BA eine Anpassung nach der Dossiereinreichung in einem laufenden Verfahren erst in seiner Beschlussfassung vornehmen, so wie zuletzt beim Wirkstoff Mepolizumab (G-BA 2022a). Zudem sind auch Veränderungen der zVT für ein Anwendungsgebiet als Folge eines Beschlusses möglich, die dann für nachfolgende Verfahren relevant sind. Dies kann z. B. auch dadurch erfolgen, dass ein AMNOG-Arzneimittel selbst zur zVT wird, wie zum Beispiel der Wirkstoff Dupilumab im Therapiegebiet der atopischen Dermatitis (G-BA 2021).
Transparenz der Änderungen
Wie oben bereits erwähnt, ist die Änderung der zVT eine Abwägungsentscheidung des G-BA, für die es keine klar vorgegebene Systematik gibt. Eine Begründung für die ggf. vorgenommene Änderung wird (wie auch bei der Festlegung der zVT selbst) erst in den tragenden Gründen zum späteren Nutzenbewertungsbeschluss veröffentlicht. Eine solche öffentlich verfügbare Erklärung zur Änderung der zVT in einem Anwendungsgebiet erfolgt jedoch nur bei Änderungen in bereits laufenden Verfahren. Diese expliziten Ausweisungen in den tragenden Gründen lassen sich daher klar identifizieren. Eine Änderung der zVT in einem bereits laufenden Verfahren fand in den letzten zwei Jahren demnach in etwa jedem fünften Verfahren statt (abgeschlossene Verfahren mit Verfahrensbeginn seit dem 1.12.2019). Änderungen, die vor der Dossiereinreichung erfolgen, werden in den tragenden Gründen des G-BA als solche nicht aufgeführt und auch nicht begründet, können jedoch in einigen Fällen den Herstellerdossiers entnommen werden (G-BA 2018). Eine Quantifizierung zur Häufigkeit solcher Änderungen ist daher nicht möglich. Insgesamt dürfte jedoch damit der Anteil an Verfahren mit einer zuvor erfolgten Anpassung der zVT deutlich höher liegen.
Kommunikation an die pharmazeutischen Unternehmen
Für die pharmazeutischen Unternehmen gab es in den vergangenen Jahren verschiedene Möglichkeiten, Informationen hinsichtlich der Anpassungen einer zVT zu bekommen. Zum einen wurden die Unternehmen nach Abschluss einer G-BA-Beratung bei erfolgten Änderungen der zVT zu einem späteren Zeitpunkt durch den G-BA selbst informiert. Zum anderen konnten Auskünfte zur Änderung durch einen erneuten Beratungsantrag beim G-BA seitens des Herstellers veranlasst werden. Außerdem konnten Informationen zu aktuellen Vergleichstherapien aus der Beschlusspraxis des G-BA entnommen werden, sofern aus dem Wortlaut der Anwendungsgebiete solcher Arzneimittel Rückschlüsse auf andere gezogen werden konnten.
Im Jahr 2022 stellte jedoch der G-BA sein seit Jahren praktiziertes Vorgehen einer Kommunikation der Änderungen ein. Nach Abschluss eines Beratungsverfahrens erfolgt seither keine Information an die pharmazeutischen Unternehmen mehr (G-BA 2022b). Es liegt demnach nun ausschließlich im Verantwortungsbereich des betroffenen pharmazeutischen Unternehmers die Aktualität der zweckmäßigen Vergleichstherapie spätestens zur Erstellung eines Dossiers für die Nutzenbewertung zu prüfen. Dabei verweist der G-BA auf die Möglichkeit einer erneuten Beratung.
Auswirkungen auf die AMNOG-Verfahren
Das Ausmaß der Auswirkung einer zVT-Änderung auf das jeweilige AMNOG-Verfahren hängt vom Umfang und von den Details ab. Eine objektive Einschätzung der Konsequenzen ist dabei nur bedingt möglich. Dennoch lassen sich aus der bisherigen Praxis grob einige Szenarien abbilden. So kann z.B. eine Ergänzung einer aus mehreren alternativen Therapien (oder-Verknüpfung) bestehenden zVT um eine weitere Option, zunächst keine unmittelbaren Auswirkungen auf das Ergebnis der Nutzenbewertung haben. Auch eine solche Veränderung hat jedoch stets Konsequenzen für den Rahmen der anschließenden Verhandlungen nach § 130b SGB V, insb. wenn der Korb der Vergleichstherapien um generische oder patentgeschützte Arzneimittel maßgeblich verändert wird.
Andere zVT-Änderungen haben hingegen unmittelbare Auswirkungen auf die Nutzenbewertung und können den Unterschied zwischen belegten und nicht belegten Zusatznutzen ausmachen. Eine Änderung kann dazu führen, dass eine Studie für die Nutzenbewertung erst nach dem Stellungnahmeverfahren als geeignet eingestuft wird, da der darin verwendete Komparator als geeignete Umsetzung der zVT anerkannt wird. So zum Beispiel im Verfahren zum Wirkstoff Tucatinib mit einer Änderung der Vergleichstherapie hin zur einer Therapie nach ärztlicher Maßgabe und folglich einer Berücksichtigung des Vergleichs mit Trastuzumab plus Capecitabin (G-BA 2021b).
Auf der anderen Seite kommt es auch vor, dass eine Studie mit einem direkten Vergleich vom G-BA als nicht mehr verwertbar eingestuft wird, da der Studienkomparator im laufenden Verfahren nicht mehr als zVT gilt. Da die Beratung des G-BA nicht verbindlich ist, kann eine Änderung der zVT auch dann stattfinden, wenn der Komparator einer Studie vom G-BA explizit empfohlen wurde oder die jeweilige Studie extra für die AMNOG-Nutzenbewertung (wie im Falle des Verfahrens zum Wirkstoff Risankizumab) in Übereinstimmung mit G-BA-Vorgaben durchgeführt wurde (G-BA 2019). Änderungen der zVT können dabei auch dazu führen, dass ein vom IQWiG im Verfahren zunächst festgestellter Zusatznutzen, im anschließenden G-BA-Beschluss nicht mehr anerkannt wird, da eine Änderung der zVT im laufenden Verfahren erfolgt. Diese Auswirkungen waren z.B. in den Verfahren zu den Wirkstoffen Nivolumab oder Mepolizumab festzustellen (G-BA 2017, 2022a).
Handlungsoptionen für pharmazeutische Unternehmen
Bei einer Änderung der zVT stellt sich die Frage, wie ein pharmazeutisches Unternehmen darauf reagieren kann. Dies ist stets von der konkreten Datensituation und vom Zeitpunkt abhängig. Bestimmte frühzeitige Änderungen, wie z. B. die Ergänzung einer zVT um eine weitere alternative Option, die keine Auswirkungen auf die Eignung der einzureichenden Studie hat, erfordern lediglich eine Aktualisierung der Evidenzrecherche und der Kostenangaben.
Bei Änderungen im laufenden Verfahren ergeben sich in der Beschlusspraxis mehrere Konstellationen. In einigen Fällen führt eine Anpassung der zVT dazu, dass eine Studie erst nach dem Stellungnahmeverfahren als geeignet eingestuft wird. In solchen Fällen kann die bereits eingereichte Studie in einem vom IQWiG zu erstellenden Addendum nachträglich bewertet und im Beschluss berücksichtigt werden. Eine erneute Durchführung des Nutzenbewertungsverfahrens wird in solchen Fällen vom G-BA als nicht erforderlich angesehen (G-BA 2021b).
In anderen Fällen ändert der G-BA zwar die zVT, zieht jedoch daraus keine unmittelbaren Konsequenzen für den Zusatznutzennachweis. So z.B., wenn die vorgelegten Daten laut G-BA unabhängig von der Frage der ausreichenden Umsetzung der zVT nicht geeignet seien, einen Zusatznutzen zu belegen, weshalb eine Änderung der zVT eine erneute Durchführung des Nutzenbewertungsverfahren nicht erforderlich mache (G-BA 2021a).
Bei einigen Änderungen befristet der G-BA hingegen die Verfahren regelhaft um sechs Monate. Da die zVT erst im laufenden Verfahren angepasst wurde, wird laut dem G-BA dem pharmazeutischen Unternehmer dadurch die Möglichkeit eingeräumt, ein neues Dossier unter Berücksichtigung der aktuellen zVT einzureichen (G-BA 2021c). Diese Befristung kann jedoch vom G-BA später aufgehoben werden, wenn der pharmazeutische Unternehmer (wie im Falle des Verfahrens zum Wirkstoff Ozanimod) ausdrücklich auf die Möglichkeit der Neueinreichung eines Dossiers unter Berücksichtigung der neu bestimmten zVT verzichtet, da keine direktvergleichenden Daten vorliegen und einem optionalen indirekten Vergleich methodische Gründe entgegenstehen (G-BA 2021c).
Eine sehr seltene und neue Praxis des G-BA ist die vorläufige Aussetzung der Beschlussfassung für sechs Monate aufgrund der zVT-Änderung, wie im Falle des Verfahrens zum Wirkstoff Ponesimod (G-BA 2021d). Der G-BA begründet dies damit, dass der Hersteller eine direkt vergleichende Studie zur neuen zVT bereits vorgelegt hat, der Studienkomparator jedoch zum Zeitpunkt der Beauftragung des IQWiG noch nicht Bestandteil der zVT war. Bis zur Vorlage der neuen Nutzenbewertung sei daher eine Entschließung des G-BA mangels Vorliegens aller Sachentscheidungsvoraussetzungen nicht möglich. Die geltenden Fristen werden demnach durch die eingetretenen Änderungen der Sachentscheidungsvoraussetzungen unterbrochen, um erneut eine Nutzenbewertung und ein Stellungnahmeverfahren durchzuführen.
Als problematisch erweisen sich solche Änderungen, die aufgrund der Kurzfristigkeit keine Anpassungen des Dossiers mehr erlauben (wie z. B. im aktuellen Verfahren zum Wirkstoff Ertugliflozin), soweit diese überhaupt möglich sind (G-BA 2022). Bei gravierenden Änderungen der zVT können, trotz einer frühzeitigen Information vor der Dossiereinreichung, keine adäquaten Anpassungen mehr vorgenommen werden, wenn z.B. eine Zulassungsstudie unter Berücksichtigung einer frühen G-BA-Beratung sich bereits in der Durchführung befindet (G-BA 2018).
Diskussion und Empfehlungen
Es ist anzuerkennen, dass eine zVT dem allgemein anerkannten Stand der medizinischen Erkenntnisse und der Versorgungsgeschehen entsprechen sollte. Ebenso ist es nachvollziehbar, dass diese Voraussetzungen sich im Laufe der Zeit verändern können. In manchen Anwendungsgebieten, wie z.B. in Bereichen der Onkologie vollzieht sich dieser Wechsel aufgrund innovativer Behandlungsmöglichkeit sehr schnell (Italia 2019). Diesem Wandel muss auch die zVT in einem G-BA-Beschluss Rechnung tragen. Zugleich sind bei der Festlegung auch weitere Faktoren zu berücksichtigen, ohne die das Gesamtgefüge aus Arzneimittelforschung und anschließender HTA-Regulierung nicht optimal funktionieren kann. Dies ist zum einen die Konsistenz der Nutzenbewertung, um eine einheitliche Bewertung zu gewährleisten. Eine Änderung der zVT ist damit gemäß den rechtlichen Vorgaben auch eine Abwägung zwischen einem Wandel des Standes der medizinischen Erkenntnisse (der sich sehr „selten quasi über Nacht ändert“ (LSG Berlin-Brandenburg 2013)) und der Konsistenz in der Bewertung eines Anwendungsgebietes bzw. einer Wirkstoffklasse. Zum anderen ist dies die Planungssicherheit für die pharmazeutischen Unternehmen. Dies erweist sich als das zentrale Problem der zVT-Änderung, insb. wenn dadurch eine Studie nach G-BA-Vorgaben anschließend als nicht mehr verwertbar eingestuft wird. Die im Vertrauen auf die G-BA-Beratung getätigten Investitionen in eine geeignete Studienlage werden damit weder in der Bewertung noch in der Erstattungssituation angemessen honoriert. Diese Situation schafft erhebliche Unsicherheiten für die Hersteller und kann sich so negativ auf Innovationen auswirken.
Planungssicherheit nach zVT-Beratung
Bei Überlegungen zur Anpassung einer zVT und bei Beschlüssen sollte über ergänzende rechtliche Vorgaben im SGB V die Studienlage des Herstellers besser berücksichtigt werden, wenn diese auf Grundlage einer G-BA-Beratung generiert wurde. Die zuvor beratene Vergleichstherapie, für die eine klinische Studie generiert wurde, sollte als Folge im Korb der Vergleichstherapien zusätzlich berücksichtigt werden, wenn der G-BA nachträgliche Änderungen der Vergleichstherapie für unvermeidlich hält. Dieser Lösungsansatz kann als Überbrückungsregelung für die Studienlage des Herstellers dienen, in Situationen, in denen sich der Stand der medizinischen Erkenntnisse graduell ändert. Dies würde zu mehr Akzeptanz der generierten klinischen Studien führen, die Planungssicherheit für Hersteller verbessern und negative Auswirkungen auf die Versorgung vermeiden.
Transparenz bei zVT-Änderungen
Kritisch zu erwähnen ist die vom G-BA kürzlich eingestellte Praxis der proaktiven Information an die zuvor beratenen pharmazeutischen Unternehmen bei Änderungen im Wortlaut der zVT. In Kombination mit der fehlenden Verbindlichkeit der Beratung bedeutet dies, dass die Beratungsleistung keinerlei Verlässlichkeit aufweist und bereits in kürzester Zeit nicht mehr einer neu definierten Position des G-BA zur zVT entsprechen könnte. Dies stellt nicht nur die Aussagekraft einer Beratung grundsätzlich in Frage. Denn der Beratung kommt (auch aufgrund des weitreichenden Rechtsmittelausschlusses) eine besondere Bedeutung zu.
Daher wäre der G-BA auch wegen des Grundsatzes des fairen Verfahrens gehalten, bei erfolgten Änderungen seiner Beratung und der damit über Änderungen seiner Entscheidungsgrundlagen die pharmazeutischen Unternehmer möglichst frühzeitig und umfassend zu informieren (LSG Berlin-Brandenburg 2013). Außerdem wäre zu erwarten, dass ausbleibende Informationen zu den Beratungen zu einer deutlichen Zunahme zusätzlicher Nachberatungen führen wird. Die pharmazeutischen Unternehmen sind nun in einem stärkeren Ausmaß gezwungen, sich in kürzeren Zeitabständen zur aktuellen Sichtweise des G-BA bezüglich potenzieller zVT-Änderungen beraten zu lassen. Die ohnehin nicht ausreichenden Kapazitäten bei den Beratungszeitfenstern des G-BA werden dadurch noch mehr unnötig blockiert. Eine proaktive Kommunikation des G-BA bei Änderungen ist somit zwingend erforderlich, um den Grundsatz des fairen Verfahrens, die Verlässlichkeit und die Beratungskapazitäten zu gewährleisten.
Zugleich ist auch eine transparente Darstellung zu allen Änderungen der zuvor beratenen zVT nötig. Aktuell werden solche Anpassungen lediglich dann eindeutig ausgewiesen, wenn sie erst im laufenden Verfahren vorgenommen werden. Dadurch lässt sich nur selten nachvollziehen, welche zVT ursprünglich beraten hat, wann, wie häufig und vor allem aus welchen Gründen diese anschließend verändert wurde.
Transparenz der zVT-Festlegung
Der G-BA veröffentlicht die von ihm festgelegte zVT sowie auch das Dokument zu „Informationen zur zweckmäßigen Vergleichstherapie“ erst zusammen mit der Nutzenbewertung. Nicht erkennbar ist dabei, warum diese vorhandenen Entscheidungsgrundlagen nicht schon zum Beginn des Verfahrens bekannt gegeben werden. Eine sachliche Begründung gibt es dazu nicht. Wie zudem bereits erwähnt, enthält das Dokument „Informationen zur zweckmäßigen Vergleichstherapie“ zwar nachvollziehbare und damit begrüßenswerte Informationen zur Recherchestrategie sowie zu Ergebnissen dieser Recherche. Die zur zVT-Festlegung vorgenommenen Abwägungen bleiben jedoch für die Dauer der Nutzenbewertung und das gesetzlich vorgeschriebene Stellungnahmeverfahren intransparent. Die hierzu notwendigen tragenden Gründe werden erst mit dem Beschluss veröffentlicht. Diese Verzögerung bei der Transparenz der Spielregeln ist insgesamt nicht sachgerecht. Die festgelegte zVT, das Dokument zur zVT-Recherche sowie die tragenden Gründe zur zVT-Festlegung (und ggf. den zuvor beratenen Fassungen) sollten daher zusammen bereits zum Zeitpunkt des Verfahrensbeginns vom G-BA veröffentlicht werden.
Fazit
Die Festlegung der zweckmäßigen Vergleichstherapie ist eine zentrale Komponente der AMNOG-Nutzenbewertung und ist entscheidend für die Bewertung des Zusatznutzens eines neuen Arzneimittels. Nach einer Beratung erfolgen jedoch in vielen Fällen nachträgliche Änderungen der zVT, die massive Konsequenzen für die Bewertung haben können. Für die Gewährleistung der Planungssicherheit sollte die beratene zVT, für die eine klinische Studie generiert wurde, zusätzlich berücksichtigt werden. Die Transparenz der Änderungen ist zugleich nicht hinreichend. Daher sollte eine proaktive Kommunikation des G-BA bei Änderungen erforderlich sein, um den Grundsatz des fairen Verfahrens, die Verlässlichkeit und die Beratungskapazitäten zu gewährleisten. Ebenso ist eine bessere Transparenz bei Änderungen der zVT vor dem Verfahrensbeginn sowie bei der Festlegung selbst erforderlich. <<
von:
Dr. PH Andrej Rasch, Senior Manager Nutzenbewertung und HTA-Koordination beim Verband forschender Arzneimittelhersteller e.V.
Zitationshinweis: Rasch, A.: „Änderungen der zweckmäßigen Vergleichstherapie“, in „Monitor Versorgungsforschung“ (05/22), S. 32-36. http://doi.org/10.24945/MVF.05.22.1866-0533.2440
Literatur
Italia N et al. (2019): Fast changing appropriate comparators in German AMNOG benefit assessments in multiple myeloma, In: Value in Health, Vol. 22, Suppl. 3, S502
G-BA (2017): Nutzenbewertungsverfahren zum Wirkstoff Nivolumab (neues Anwendungsgebiet: Melanom, Kombination mit Ipilimumab). In: https://www.g-ba.de/informationen/nutzenbewertung/240/ (abgerufen am 13.6.2022)
G-BA (2018): Nutzenbewertungsverfahren zum Wirkstoff Fluticasonfuroat/Umeclidinium/Vilanterol (COPD). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/352/ (abgerufen am 13.6.2022)
G-BA (2019): Nutzenbewertungsverfahren zum Wirkstoff Risankizumab (Plaque-Psoriasis). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/465/ (abgerufen am 15.6.2022)
G-BA (2021): Nutzenbewertungsverfahren zum Wirkstoff Baricitinib (neues Anwendungsgebiet: atopische Dermatitis). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/608/ (abgerufen am 15.6.2022)
G-BA (2021a): Nutzenbewertungsverfahren zum Wirkstoff Dostarlimab (Endometriumkarzinom, nach vorheriger Platin-basierter Therapie). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/708/ (abgerufen am 15.6.2022)
G-BA (2021b): Nutzenbewertungsverfahren zum Wirkstoff Tucatinib (Mammakarzinom, HER2+, mind. 2 Vortherapien, Kombination mit Trastuzumab und Capecitabin). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/663/ (abgerufen am 15.6.2022)
G-BA (2021c): Nutzenbewertungsverfahren zum Wirkstoff Ozanimod (Schubförmig remittierende Multiple Sklerose). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/566/ (abgerufen am 15.6.2022)
G-BA (2021d): Nutzenbewertungsverfahren zum Wirkstoff Ponesimod (Schubförmige Multiple Sklerose). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/706/ (abgerufen am 15.6.2022)
G-BA (2022): Nutzenbewertungsverfahren zum Wirkstoff Ertugliflozin (Diabetes mellitus Typ 2). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/759/ (abgerufen am 13.6.2022)
G-BA (2022a): Nutzenbewertungsverfahren zum Wirkstoff Mepolizumab (Neues Anwendungsgebiet: Chronische Rhinosinusitis mit Nasenpolypen). In: https://www.g-ba.de/bewertungsverfahren/nutzenbewertung/764/ (abgerufen am 13.6.2022)
G-BA (2022b): Antworten auf häufig gestellte Fragen zum Verfahren der Nutzenbewertung. In: https://www.g-ba.de/themen/arzneimittel/arzneimittel-richtlinie-anlagen/nutzenbewertung-35a/faqs/ (abgerufen am 10.6.2022)
LSG Berlin-Brandenburg (2013): Beschluss vom 28.02.2013, Aktenzeichen L 7 KA 106/12 KL ER. In: https://gesetze.berlin.de/bsbe/document/JURE130004466