Steuerung des Gesundheitswesens mit Big Data
http://doi.org/10.24945/MVF.03.19.1866-0533.2139
>> Es gebe kaum Zweifel darüber, dass bei der Entwicklung und Zulassung von Arzneimitteln zunehmend Daten eingesetzt werden, die aus ganz unterschiedlichen Quellen und Umfeldern stammen, heißt es gleich zu Beginn des Summary Reports „HMA-EMA Joint Big Data Taskforce“ (Februar 2019). Das wachsende Volumen und die Komplexität der Daten, die über verschiedene Geräte gesammelt würden, böten Chancen für die Steuerung der nationalen Gesundheitssysteme und ein besseres Verständnis von Krankheiten und die Wirksamkeit von Arzneimitteln beziehungsweise medizinischen Produkten. Die Akzeptanz dieser Daten im regulatorischen Kontext setze aber ein gewisses Verständnis voraus: im Hinblick auf die Herkunft und Qualität der Daten sowie bezüglich neuer Ansätze und Methoden zur Verarbeitung und Analyse dieser Daten, etwa beim Einsatz von algorithmischen oder Machine-Learning-Methoden. „Daher muss die regulatorische Strategie festlegen, wann und wie im Produktentwicklungszyklus von Arzneimitteln die Evidenz, die aus solchen Daten hergeleitet wird, für die regulatorische Entscheidungsfindung akzeptabel ist“, fordern die Verfasser des Berichts.
Die „HMA–EMA Joint Big Data Taskforce“ hat sich mit dem Ziel formiert, die große Datenlandschaft von einer regulatorischen Perspektive aus zu beschreiben, um sicherzustellen, dass das regulatorische System der EU die Kapazität und die Fähigkeit hat, die Daten zu steuern, zu analysieren und interpretieren.
Auch wenn der Begriff Big Data weit verbreitet sei, gebe es keine allgemein akzeptierte Definition, merken die Autoren an. Jede Definition sollte aber aus ihrer Sicht nicht nur das Konzept umfassen, laut welchem Big Data, ihre Typen und Formen sehr heterogen und zahlreich sind, sondern die Konzepte sollten viel mehr Bezug auf die Komplexität und Herausforderungen nehmen, die mit der Integration der Daten einhergehen, um letztendlich eine kombinierte Analyse zu ermöglichen.
Im regulatorischen Kontext hat die Taskforce Big Data als „extrem große Datasets“ definiert, „die komplex, multidimensional, unstrukturiert und heterogen sein können, die sehr schhnell anwachsen, und die rechnerisch analysiert werden können, um Muster, Trends sowie Zuordnungen aufzudecken“.
Im Allgemeinen verlangten Big-Data-Sets fortgeschrittene oder spezialisierte Methoden, um eine Antwort unter zuverlässigen Bedingungen zu liefern. Solche Methoden der Datenanalyse wie etwa Modelle und Algorithmen seien Gegenstand des wachsenden Gebietes Data Science, das Methoden aus verschiedenen Disziplinen kombiniert und für das Nutzen der Möglichkeiten von Big Data entscheidend sei.
Die Taskforce hat sich verpflichtet, alle Daten zu betrachten, die für die regulatorische Entscheidungsfindung relevant sind, und formte sechs Untergruppen, um die Datenlandschaft in den Sparten zu untersuchen:
1. Genomics,
2. Bioanalytical ‘omics (mit einem Fokus auf Proteomics),
3. Klinischen Studien,
4. Beobachtungsdaten (EHR),
5. Daten über spontane Unerwünschte Arzneimittelwirkungen,
6. Daten aus Social Media und m-Health.
Die HMA-EMA Joint Big Data Taskforce definiert ihre Aufgaben folgendermaßen:
• Ausarbeiten von relevanten Big-Data-Quellen und festlegen eines Hauptformates, in dem diese Daten vorliegen sollten;
• Beschreiben der aktuellen Landschaft, der zukünftigen Lage und der künftigen Herausforderungen durch die regulatorische Brille;
• Identifizieren von Gebieten, in denen Datenquellen existieren, die anwendbar sind;
• Eine Gap-Analyse soll den derzeitigen Stand der Expertise über das europäische regulatorische Netzwerk hinweg bestimmen, sowie künftige Bedarfe und Herausforderungen;
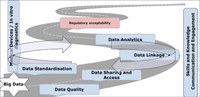
• Erstellung einer Liste von Empfehlungen und einer Big-Data-Roadmap (s. Abb. unten).
Der aktuelle Report ist eine übergreifende Zusammenfassung der Ergebnisse aus den Untergruppen inklusive Empfehlungen zu gemeinsamen Schritten auf dem Weg hin zur regulatorischen Akzeptanz von Big Data. Die Empfehlungen beginnen mit der Standardisierung der Daten. Daraufhin folgt die Verbesserung der Datenqualität, damit Daten geteilt, verarbeitet und analysiert werden können. Diese Schritte seien nicht notwendigerweise aufeinanderfolgend, betonen die Autoren, oft seien sie voneinander unabhängig oder wiederholen sich. Teils sei auch ein konstantes Engagement der externen Stakeholder nötig, um regulatorische Bedarfe festzuhalten. Zusätzlich gebe es über alle Big-Data-Domänen hinweg die Notwendigkeit, dafür zu sorgen, dass das europäische regulatorische Netzwerk ausreichend Expertise entwickelt und beibehält, um Big Data zu steuern, zu interpretieren und kritisch zu bewerten.
Die Taskforce führte unter anderem zwei Studien durch. Für die erste Studie befragte sie die National Competent Authorities (NCAs) zur derzeitigen Situation im europäichen regulatorischen Netzwerk, im Besonderen zur verfügbaren Expertise und den Kompetenzen in der Analyse und Interpretation von Big Data.
An der Umfrage nahmen immerhin 24 von angefragten 33 NCAs teil. Die Ergebnisse der Studie zeigen, dass es derzeit auf dem nationalen Level eine sehr begrenzte Expertise in der Analyse von Big Data gibt. Zum Teil sei der Glaube verbreitet, dass solch eine Expertise zum jetzigen Zeitpunkt nicht benötigt wird, da es nur eine geringe Nachfrage an entsprechender Beratung seitens der Industrie gebe. Nur drei NCAs berichteten davon, Anfragen zur Eignung oder einer Big-Data-Set-Analyse im Rahmen der wissenschaftlichen und verfahrenstechnischen Beratung erhalten zu haben.
Darüber hinaus gaben 8 von 24 NCAs an, über keine Inhouse-Expertise in Biostatistics zu verfügen, was heute bereits eine analytische Kernkompetenz darstelle, so die Verfasser des Reports. Dies schließe die statistische und analytische verfügbare Expertise innerhalb der EMA nicht ein. Die Mehrheit der NCAs glaubt offenbar, dass ein Anstieg der Expertise in diesem Feld innerhalb der nächsten fünf Jahre nötig sein wird. Einige haben dazu bereits konkrete Pläne, die innerhalb der nächsten drei Jahre umgesetzt werden sollen. Die Verfasser des Reports betonen allerdings in diesem Zusammenhang, dass der Zeitrahmen zur Umsetzung von den NCAs ganz unterschiedlich angesetzt wurde und dass die Interpretation der Zeitfenster je nach spezifischer Expertise variiert hat.
Mehr als die Hälfte der NCAs gab an, derzeit Zugang zu externen Big Data-Sets zu haben (größtenteils RWD-, ADR-Daten, Beobachtungsstudiendaten und Daten aus Klinischen Studien) sowie relevanten In-House-Systemen und -Tools (größtenteils SAS und R).
Wenige NCAs berichteten von externer Zusammenarbeit mit akademischen Institutionen. „Es scheint klar zu sein, dass es eine wachsende Herausforderung sein wird, eine ausreichende Expertise in dem regulatorischen Netzwerk aufrechtzuerhalten“, prognostizieren die Autoren des Reports. Eine starke Zusammenarbeit mit akademischen Institutionen müsse künftig etabliert werden, um den Trainingsbedarf des regulatorischen Netzwerks zu decken und seine Arbeitsleistung zu stärken.
Einige wenige NCAs gaben an, Evidenz -Informationen erhalten zu haben, die aus Big-Data-Sets innerhalb regulatorischer Verfahren abgeleitet wurden. Die meiste Erfahrung gab es offenbar in der Unterstützung von Pharmakovigilanz-Bedarfen im Rahmen von Post-Autorisierungsverfahren inklusive PASS, PAES, RMPS, PSURS und mit Data Sets aus Beobachtungsstudien, Registern, Versicherungsdaten und EHRs. Als Gebiete, in denen Big Data wahrscheinlich zuerst angewandt werden wird, wurden Signal-entdeckung, Gültigkeitsprüfung und Bewertung als regulatorische Gebiete definiert, in denen das Natural Language Processing (NLP) als wichtiger Fortschritt gilt. Als weitere wichtige Schritte wird das Teilen von Daten aus Klinischen Studien und die Nutzen-Risiko-Bewertung von Hochrisikopopulationen genannt, die oft aus Klinischen Studien ausgeschlossen sind. Als größte Herausforderung für den Gebrauch von Big Data in der regulatorischen Entscheidungsfindung nennen die NCAs die Datenqualität, gefolgt von der Harmonisierung der Daten und Integration in Europa sowie die letztendliche Bewertung der abgeleiteten Evidenz.
Die Response-Rate im Rahmen der Studie mit der Industrie war niedriger als erwartet. Die befragten zwei Gruppen der Industrie waren ähnlich groß und bestanden zum einen aus großen Unternehmen (>250 Mitarbeiter) und zum zweiten aus kleinen bis mittleren Unternehmen (SMEs; 10 bis 250 Mitarbeiter).
Interessante Diskrepanzen offenbarten sich im Hinblick auf den Business-Fokus dieser Unternehmen. So hoben etwa große Pharmaunternehmen personalisierte Medizin, die Analyse der derzeitigen medizinischen Versorgung und Design von Klinischen Studien als Gebiete hervor, in denen Big Data den größten potenziellen Einfluss haben. SMEs hingegen nannten die Patient Reported Outcomes, Outcome Identification und Signalentdeckung als wichtigste Gebiete. Das spiegele möglicherweise den Fokus der SMEs, der auf technologiebezogenen Möglichkeiten liegt, mutmaßen die Autoren, wie etwa m-Health-Apps und Wearables oder auch der Behandlung von Seltenen Erkrankungen.
Die Herausforderungen, die von Industrieteilnehmern hervorgehoben wurden, sind die gleichen, die von den NCAs genannt wurden – also Data Access, Data Intergration, Daten-Bewertung und Datenreproduzierbarkeit. Zu-sätzlich stehen aber auch Datensicherheit und Datenschutz im Fokus der Industrie.
In der Studie war auch die Frage enthalten: „Welche Maßnahmen könnte das regulatorische Netzwerk einführen, um die genannten Herausforderungen anzugehen?“ Maßnahmen, die von großen Pharmaunternehmen sowie SMEs genannt wurden, waren regulatorische Leitlinien und Informationen sowie die Beschaffung von Data Sets. Das Letztgenannte zähle üblicherweise nicht zum Aufgabenbereich von regulatorischen Agenturen, dennoch zeigten Aktionen wie Policy 00709 eine regulatorische Unterstützung von Data-Sharing-Leitlinien. Die Empfehlungen der Taskforce beinhalten außerdem eine Reihe von Schlüsselmßnahmen, die notwendig sind, um eine Data-Sharing-Kultur unter den Daten-Inhabern voranzubringen. <<
Autorin: Olga Gilbers
Zitationshinweis:
Gilbers, O., „Steuerung des Gesundheitswesens mit Big Data“ in „Monitor Versor-
gungsforschung“ (03/19), S. 12-13; doi: 10.24945/MVF.03.19.1866-0533.2139
Kernempfehlungen der HMA-EMA-Taskforce
- Globale, einheitliche und flächendeckende Standards zur Interoperabilität von Daten
- Charakterisierung der Datenqualität über verschiedene Datenquellen hinweg ist essenziell, um die Vertrauenswürdigkeit der abgeleiteten Evidenz nachzuvollziehen
- Entwicklung von zeitgemäßen, effizienten und nachhaltigen Rahmenwerken für Data Sharing und Data Access
- • Etablierung von Mechanismen zur Unterstützung der Data-Sharing-Kultur sowie
- Mechanismen zur Verknüpfung von Daten, um neuartige Insights zu gewinnen
- Harmonisierung ähnlicher Datasets
- Entwicklung von klaren Rahmenwerken zur Validierung von analytischen Ansätzen, um zu bestimmen, ob diese zur Unterstützung regulatorischer Entscheidungsfindung geeignet sind
- Vorantreiben von neuen analytischen Ansätzen zur Modellierung von großen Datasets zu regulatorischen Zwecken
- Erstellung von regulatorischen Leitlinien zur Akzeptierbarkeit der Evidenz, die aus Big-Data-Quellen abgeleitet wird.
- Sicherstellen einer effektiven Implementierung von neuen Regularien für Devices und in-vitro Diagnostics (IVDs), die mit dem Einsatz von medizinischen Produkten verbunden sind, inklusive Monitoring der Sicherheit
- Die mit der Regulatorik befassten Mitarbeiter müssen sich entsprechende Skills zu Big Data aneignen
- Proaktives regulatorisches Engagement mit externen relevanten Big-Data-Stakeholdern, um die Strategie mitzubeeinflussen und regulatorische Bedarfe aufzuzeigen
Die detaillierten Empfehlungen der einzelnen Subgruppen sind unter http://www.hma.eu abrufbar