AMNOG, Zusatznutzen, regionale Marktdurchdringung
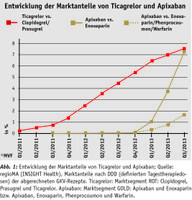
>> Mit Inkrafttreten des Arzneimittelmarktneuordnungsgesetzes (AMNOG) am 01. Januar 2011 wurde die frühe Nutzenbewertung neuer Wirkstoffe nach §35a SGB V eingeführt. Dabei bildet das vom pharmazeutischen Unternehmer eingereichte Dossier die Grundlage für die Bewertung des Zusatznutzens. Das erste Arzneimittel mit abgeschlossenem Nutzenbewertungsverfahren war mit G-BA-Beschluss vom 15.12.2011 Ticagrelor (Brilique®). Dem Thrombozytenaggregationshemmer zur Therapie der Koronaren Herzkrankheit wurde ein Beleg für einen beträchtlichen Zusatznutzen bei Patienten mit instabiler Angina pectoris (IA) bzw. Patienten mit Myokardinfarkt ohne das spezifische EKG-Infarktzeichen der ST-Strecken-Hebung (NSTEMI) bescheinigt. Diese Patientengruppe bildet ca. 73 Prozent der gesamten angegebenen Patientenpopulation für Ticagrelor ab. Für zwei weiter eingeschränkte Patientengruppen ergab sich ein Anhaltspunkt auf einen nicht quantifizierbaren Zusatznutzen. Für drei Patientengruppen gab es keinen Beleg für einen Zusatznutzen. Im Nutzenbewertungsprozess von Ticagrelor (+ASS) wurden Clopidogrel (+ASS) sowie Prasugrel (+ASS), das sich insbesondere durch eine signifikante Reduktion nichttödlicher Herzinfarkte auszeichnet (AM-Rl Anlage IV), als zweckmäßige Vergleichstherapien gewählt. In den Anwendungsgebieten mit einem Zusatznutzen gilt Ticagrelor ab dem ers-ten Behandlungsfall als Praxisbesonderheit nach § 106 Abs. 5a SGB V.
Zusätzlich wird der
...
Ausführlicher Bericht: siehe Archiv, MVF 06/13 (Zugang nur für Abonnenten)