Infliximab-Biosimilars im Aufwärtstrend
http://doi.org/10.24945/MVF.03.16.1866-0533.1958
>> Biopharmazeutika haben die Behandlung schwerer Krankheiten revolutioniert: Insbesondere bei Stoffwechsel- und Autoimmunerkrankungen stellen die TNF-alfa-Inhibitoren eine wichtige Therapieoption dar. Zurzeit sind mit Certolizumab, Golimumab, Adalimumab und Infliximab vier monoklonale Antikörper sowie das gentechnisch synthetisierte Protein Etanercept auf dem Markt. Von diesen biopharmazeutischen Arzneimitteln wurden im Jahr 2015 über 35,4 Mio. definierte Tagestherapiedosen (defined daily dose, DDD) im gesamten ambulanten GKV-Markt verordnet. Dies entspricht zwar nur 0,08 Prozent aller verordneten DDD – gemessen nach Apothekenverkaufspreisen sind die TNF-alfa-Inhibitoren jedoch mit einem Marktanteil von über 5 Prozent die umsatzstärkste ATC4-Klasse. Mit einem deutlichen DDD-Anstieg von 19,5 Mio. im Jahre 2010 auf 35,4 Mio. in 2015 ergibt sich ein Wachstum von 81 Prozent (Quelle: regioMA, INSIGHT Health). Zum Einsatz kommen die TNF-alfa-Inhibitoren beispielsweise bei rheumatoider Arthritis, wo sie Bestandteil der (S1)-Leitlinien-gerechten Therapie sind. Für die Patienten stellen sie eine Therapieoption nach mindestens 6-monatiger Behandlung mit Basistherapeutika (u.a. Methotrexat) oder bei Kontraindikationen dar (vgl. Deutsche Gesellschaft für Rheumatologie e.V.). Obwohl die Ausgaben für TNF-alfa-Inhibitoren bis zu 33-mal höher sind als für das generische Basistherapeutikum Methotrexat (Quelle: regioMA, INSIGHT Health) gibt es Hinweise auf eine Kosteneffektivität bei indikationsgerechtem Einsatz (vgl. Zentrum für Sozialpolitik, Universität Bremen).
Infliximab-Biosimilars – Switch gelingt?
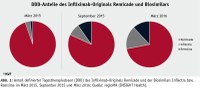
Mit Blick auf den generischen Markt besteht die Aussicht, dass auch Biosimilars in ähnlichem Ausmaß zur Ausgabendämpfung im Arzneimittelbereich beitragen könnten. Wird der Umsatz nach Apothekenverkaufspreis in 2015 durch die Anzahl an Verordnungen dividiert, so liegt der durchschnittliche Preis für ein Generikum 42,1 Prozent unter dem des patentfreien Originalproduktes. Die Einsparmöglichkeiten bei Biosimilars liegen allerdings deutlich darunter. Im Vergleich zum Infliximab-Original „Remicade“ weisen die beiden Biosimilars „Remsima“ und „Inflectra“ mit Markteintritt im Februar 2015 eine Preisdifferenz von 22,3 Prozent auf. Auch verzeichnet „Remicade“ seit Einführung der Biosimilars keinen Zuwachs mehr, obwohl die Verordnungen für Infliximab insgesamt seit 2013 moderat gestiegen sind. Stattdessen nehmen die Marktanteile der Nachahmer stetig zu, wobei der Absatz von „Inflectra“ den des zweiten Biosimilars Remsima leicht übersteigt (Quelle: regioMA, INSIGHT Health). Wie Abbildung 1 zeigt, liegt der Biosimilaranteil im März 2016 nach verordneten DDD bei 28,1 Prozent und damit deutlich über den Anteilen im ersten Monat sowie ein halbes Jahr nach Markteintritt. Dies spricht neben einer vermehrten Anwendung der Biologika-Therapie auch für einen Switch von Original zu Biosimilar. Dieser wird über die namentliche Verordnung des Wirkstoffes vollzogen, da die Substitution in der Apotheke von Original und Nachahmer nicht möglich ist. Folglich liegt der Steuerungsfokus auf der ärztlichen Verordnung, auf die unter anderem mit speziellen Versorgungsverträgen Einfluss genommen wird.
Arzneimittelversorgungsmanagement bei der TK
Ziel des sogenannten „TK-Rheumavertrages“ ist eine qualitativ hochwertige und wirtschaftliche Arzneimittelversorgung mit Biologika bei Patienten mit rheumatischen Erkrankungen. Im September 2013 zwischen der Techniker Krankenkasse (TK) und dem Berufsverband Deutscher Rheumatologen e.V. (BDRh) gestartet, beteiligen sich mittlerweile über 50 Krankenkassen an diesem bisher ersten und einzigen bundesweit ausgerollten Vertrag. Eine Ampelregelung mit den im Arzneimittelvertrag entsprechend grün, gelb oder rot gekennzeichneten Präparaten visualisiert die Wirtschaftlichkeitsprioritätenliste. Für Infliximab sind sowohl das Altoriginal als auch die beiden Biosimilars auf grün gestellt. Demnach sind seit Beginn des Vertrages im 4. Quartal 2013 im Vergleich zum 1. Quartal 2016 die verordneten Infliximab-DDD bei der TK um 33 Prozent gestiegen. Bei der Barmer GEK mit ähnlicher Mitgliederstruktur und –größe aber ohne Beteiligung am Rheumavertrag steigen die verordneten DDD im gleichen Zeitraum um 21 Prozent. Diese Entwicklung ist jedoch nicht monokausal auf den „TK-Rheumavertrag“ zurückzuführen, denn hier spielen unter anderem die von der Kasse über Infliximab abgeschlossenen Rabattverträge eine Rolle.
Open-House-Verträge: Chance oder Risiko
Im Jahr 2013 veröffentlichten die Kassen erstmalig neben den exklusiven Rabattverträgen sogenannte Open-House-Verträge, in denen einheitliche Konditionen vorgegeben werden und die pharmazeutischen Hersteller jederzeit beitreten können. Der Vertragsschluss zwischen Herstellern und Kassen erfolgt bevorzugt bereits vor Ende des Patent-ablaufs und wird unterschiedlich bewertet: Die Arbeitsgemeinschaft Pro Biosimilars weist darauf hin, dass der Arzt durch den fixen Rabatt nicht erkennen kann, welches Präparat tatsächlich das preisgünstigere ist. Somit wird er in der Regel nach wie vor auf das ihm bekannte Erstanbieterpräparat zurückgreifen. Hingegen bezeichnet die DAK Gesundheit die Verträge als ein transparentes und diskriminierungsfreies Modell, das Versorgungssicherheit und Patienten-Compliance erhöht. Die Kasse sieht den Vorteil vor allem darin, dass sich generische Wirkstoffe nach Patentablauf aufgrund der nicht-vorhandenen Exklusivität auf dem Markt etablieren können. Auf diese Weise entstehe für den pharmazeutischen Anbieter ein Zeitraum, in dem sich die Kosten für Zulassung, Entwicklung und Produktion amortisieren können (vgl. DAK Gesundheit, Positionspapier Open-Book Verfahren).
Für Infliximab haben zahlreiche Kassen Open-House-Verträge veröffentlicht. Ab April 2015 sind den Ausschreibungen der Techniker Krankenkasse sowie den Dienstleistern spectrumK und GWQ sowohl der Originalhersteller, als auch Reimporteure und die Biosimilarhersteller in unterschiedlichen Kombinationen beigetreten. In den Folgemonaten veröffentlichten auch die AOK Niedersachsen und die AOK Plus sowie weitere mitgliederstarke Krankenkassen Verträge dieser Art. Damit steigen auch die Rabattquoten - und zwar die des Infliximab-Altoriginals von 69 Prozent im 2. Quartal 2015 auf 80 Prozent im 1. Quartal 2016 und die der Biosimilars von 27 auf 91 Prozent im gleichen Betrachtungszeitraum (Quelle: NVI-KT; INSIGHT Health). Trotz der Tatsache, dass die Open-House-Verträge über alle Produkte geschlossen wurden, werden mehr Infliximab-Biosimilars unter Rabattvertrag abgegeben. Damit ergibt sich für die Hersteller eine Möglichkeit des Markteintritts. Dennoch steht die Rabattquote einer Kasse in keinem direkten Zusammenhang zur regionalen Biosimilar-Quote und damit zur Marktdurchdringung mit Nachahmerprodukten.
TNF-alfa-Zielquoten steuern ärztliche Verordnung
Im September 2015 vereinbarten der GKV-Spitzenverband und die Kassenärztliche Bundesvereinigung für das Jahr 2016 eine Rahmenvorgabe (§ 84 Abs. 7 i.V. m. Abs. 8 SGB V) für den Abschluss von regionalen Arzneimittelvereinbarungen. Diese legt unter anderem eine Verordnungsmindestquote für biosimilares Infliximab fest, mit dem Ziel den Verordnungsanteil auf über 7 Prozent zu erhöhen. Dabei werden für die einzelnen KV-Regionen individuelle Zielquoten vorgegeben, die untereinander stark variieren. Während mit 15,7 Prozent die höchste Quote in Sachsen-Anhalt vorgegeben ist, haben Mecklenburg-Vorpommern und Hamburg mit 0,4 Prozent die kleinste Zielvorgabe. Abbildung 2 zeigt, dass die Ziele im 1. Quartal 2016 von allen KV-Regionen deutlich übererfüllt wurden. Im Durchschnitt liegen die Regionen 18,6 Prozentpunkte über der Vorgabe. Anstatt der nationalen Rahmenvorgabe haben sich einzelne KVen, wie beispielsweise die KV Westfalen-Lippe individuelle Verordnungsziele für biosimilares Infliximab gesetzt. Für das Jahr 2016 soll hier ein Mindest-DDD-Anteil von 45 Prozent erreicht werden, dem die KV mit 38,8 Prozent im ersten Quartal bereits sehr nahe kommt (Quelle: regioMA, INSIGHT Health). Derweil fokussiert die KV Bayerns bei ihrer Steuerung über die sogenannte Wirkstoffvereinbarung nicht auf einzelne Biosimilars. Die Zielquote von 46,39 Prozent (über alle definierten Facharztgruppen) gilt für die kostengünstigen Leitsubstanzen Certolizumab pegol, Golimumab und Infliximab sowie Rabattvertragspräparate an allen im Markt befindlichen TNF-alfa-Inhibitoren. Mit 37,7 Prozent im ersten Quartal liegt der DDD-Anteil bereits 3,4 Prozentpunkte höher als vor einem Jahr (Quelle: NVI-KT, INSIGHT Health). Nach dem GKV-VSG müssen ab 01.01.2017 alle KVen verpflichtend regionale Vereinbarungen treffen. Hier wird es spannend sein zu beobachten, ob die Zielquoten dazu beitragen Biosimilars schneller in die Versorgung zu bringen.
Fazit
Die zunehmende Erfahrung bei der Anwendung neu zugelassener Biosimilars, die gute Studienlage für Infliximab sowie die Preisdifferenz zum Original scheinen zu einem Switch der Patienten auf die Biosimilars zu führen. Wie die positive Marktentwicklung zeigt, ist die Therapie mit Biologika einer steigenden Patientenzahl zugänglich. Im Bericht zu den Ergebnissen des Pharmadialogs vom April 2016 ist festgehalten, dass Ärztinnen und Ärzte Informationen zu Biosimilars erhalten sollen und sie im Versorgungsalltag umfassend beraten werden müssen. Eine vor dem Hintergrund komplexer Steuerungsinstrumente simpel erscheinende Maßnahme, die das Ziel einer bestmöglichen Patientenversorgung unter Berücksichtigung von Wirtschaftlichkeitskriterien und der Therapiefreiheit sinnvoll unterstützen könnte. Darüber hinaus veranlasst der Gesetzgeber die Ärzte mit Rabattverträgen und Arzneimittelzielquoten zur Verordnung von Biosimilars. Dies spiegelt sich in der zunehmenden Marktdurchdringung wider, die Anreiz für die Zulassung neuer Biosimilars sein sollte. Insbesondere vor dem Hintergrund, dass in den nächsten Jahren zahlreiche umsatzstarke Biopharmazeutika ihren Patenschutz verlieren, wird sich herausstellen, ob die bisherigen Steuerungsinstrumente den Marktzugang für Biosimilar-Hersteller attraktiver machen. <<
Autorinnen:
Kathrin Pieloth, Jana Heiler und
Esther Zöllner*
Zitationshinweis: doi: 10.24945/MVF.03.16.1866-0533.1958