Zwei Hürden – zwei Lösungsvorschläge
>> Die Gesellschaft steht vor großen Herausforderungen, heißt es am Anfang des Dokuments der Arbeitsgruppe „Wertschöpfungskette“ des Forums Gesundheitsforschung. Demografischer Wandel und die Veränderung des Lebensstils führten dazu, dass Volkskrankheiten und Mehrfacherkrankungen in der Bevölkerung zunehmen würden. Neue und innovative Präventionskonzepte, Diagnose- und Therapieverfahren sowie neue, bessere und bezahlbare Wirkstoffe für Arzneimittel würden nun dringend gebraucht. Die für die zukünftige Gesundheitsversorgung der Menschen vielversprechendsten Forschungsansätze und neue Wirkstoffkandidaten müssen nach Ansicht der Verfasser deshalb konsequenter und frühzeitiger identifiziert werden. Zudem müssen sie durch alle Entwicklungsschritte der Wertschöpfungskette professionell begleitet werden, so dass die industrielle Anschlussfähigkeit nachhaltig hergestellt werden kann.
Die Entwicklung neuer Verfahren und Wirkstoffe sei jedoch schwierig und mit hohen Entwicklungsrisiken verbunden, so die weitere Feststellung. Denn die Entwicklung sei zeitaufwändig und verursache hohe Kosten. So beanspruche die Entwicklung eines neuen Therapeutikums bis zur Zulassung 10 bis 15 Jahre und kostet bis zu einer Milliarde Euro. Die durchschnittliche Erfolgsrate liege aber bei nur 5 bis 10 Prozent. Damit Entwicklungskosten nicht weiter steigen und neue Produkte die Patienten schneller erreichen, müssen Hürden in der Wertschöpfungskette abgebaut werden, die die Translation behindern, sind die Verfasser des Dokuments überzeugt. Sie empfehlen, an zwei Punkten anzusetzen, um diese Hürden abzubauen.
Validität und Qualität der
Forschung verbessern
Die Validität und Qualität der biomedizinischen Forschung sollte verbessert werden, heißt es in der Empfehlung. Denn dies sei die Basis für eine rasche Translation von Forschungsergebnissen in die präklinische und klinische Entwicklung. Deren Ergebnisse müssen sich in den späteren Schritten der Wirkstoff- und Therapieentwicklung schließlich als reproduzierbar und verlässlich erweisen. Zudem seien sie eine Voraussetzung für den effizienten Umgang mit Forschungsressourcen und für die Glaubwürdigkeit und Konkurrenzfähigkeit der Wissenschaft – nach innen und nach außen. Als problematisch betrachtet die Arbeitsgruppe derzeit folgende Punkte in der Forschung:
• „Reproducibility Crisis“ – eine mangelhafte Reproduzierbarkeit der Ergebnisse: Nur weniger als ein Viertel aller Publikationen kann repliziert werden. Die in Tiermodellen und anderen Modellsystemen gewonnenen Forschungsergebnisse seien zudem nur teilweise auf den Menschen übertragbar. Dadurch kommen zu wenige Innovationen aus der biomedizinischen Forschung in der Patientenversorgung an. Die Ursachen für dieses Qualitätsproblem sehen die Verfasser unter anderem im System und dessen Anreizen. So würde beispielsweise der höhere Mehraufwand an Zeit und Kosten nicht honoriert, der für die qualitätsgesicherte Forschung nötig ist.
• Darüber hinaus setzten die Anreizsysteme wie die Anzahl und der Impact Faktor von Publikationen sowie kurze Projektlaufzeiten Wissenschaftler unter hohen Leistungs- und Zeitdruck. Dadurch veröffentlichten sie vielversprechende Forschungsergebnisse oft zu schnell und ohne diese vorher genügend zu überprüfen. Null- und negative Ergebnisse würden hingegen selten publiziert. Ein Teil der Forschung würde zudem von Mitarbeitern durchgeführt, die noch in der Ausbildung sind und oft nicht ausreichend angeleitet und betreut werden.
• Es fehle ein methodenkritischer Diskurs für eine Beurteilung und Einordnung der gewonnenen Ergebnisse. Den Forschenden seien zudem die natürlichen Grenzen der experimentellen Modelle zu wenig bewusst oder sie verdrängten sie. Zudem lasse die Anwendung geeigneter Biometrie in präklinischen und klinischen Studien oft zu wünschen übrig.
• Es gebe zu wenig formalisierte Qualitätssicherung in der akademischen Forschung, oder sie werde nicht ausreichend umgesetzt. Wissenschaftsverlage und Forschungsförderer fordern „Good Practice Guidance“ nach Ansicht der Verfasser bisher zu wenig ein. Die Dokumentation und Berichte über Forschungsergebnisse seien wenig standardisiert und häufig unvollständig. Im Gegensatz zu der klinischen Forschung, wo mit Hilfe der evidenzbasierten Medizin, der Priorisierung von randomisierten, multizentrischen Studien sowie von Vorschriften zur adäquaten Dokumentation ein Umdenken und damit eine Qualitätssteigerung eingeleitet wurde, fehle dieser Prozess in der Grundlagenforschung und in der präklinischen Forschung.
• Darüber hinaus übt die Arbeitsgruppe Kritik am Peer-Review-Prozess der wissenschaftlichen Zeitschriften, der zunehmend versage (vgl. dazu auch MVF 04/2017 S. 20). Immer mehr Publikationsmöglichkeiten überlasteten den Review-Prozess oder würden zunehmend ohne angemessene Qualitätssicherung durchgeführt und führten zur Veröffentlichung von Arbeiten mit nicht ausreichender Aussagekraft und von unvollständigen Arbeiten.
• Schließlich verleiteten eine immer größer werdende Abhängigkeit der akademischen Forschung von Drittmitteln und kurze Förderzyklen mit hohem Ergebnisdruck zur „Erwartungsforschung“, die oftmals mit Bias und einer unzureichenden Validierung einhergehe.
Die Arbeitsgruppe formuliert vor diesem Hintergrund konkrete Maßnahmen, die von den Wissenschaftlern umgesetzt und von den Leitungsorganen der Universitäten und der außeruniversitären Forschungseinrichtungen sowie den Forschungsförderern eingefordert, unterstützt und kontrolliert werden sollten:
• Experimente und Studiendesign zur Erhöhung der Validität von präklinischer Forschung sorgfältig planen;
• relevante Ergebnisse replizieren;
• alle Daten und Erkenntnisse für die Wissenschaft und die Allgemeinheit verfügbar machen;
• Gute Wissenschaftliche Praxis implementieren;
• mit Kulturwandel eine bessere Qualität in der Forschung schaffen;
• Verfügbarkeit und Nutzung von wissenschaftlichen Erkenntnissen vereinfachen;
• Strukturen, Instrumente und Maßnahmen zur Qualitätssicherung einfordern;
• Förderprogramme zur Qualitätssicherung auflegen;
• Kulturwandel für eine bessere Qualität in der Forschung unterstützen.
Fonds soll die Entwicklung
neuer Wirkstoffe beschleunigen
Als zweite Empfehlung zur Überwindung der Hürden in der Wertschöpfungskette der Gesundheitsforschung schlagen die Verfasser die Etablierung eines Translationsfonds vor. Dieser sei notwendig, damit die Entwicklung neuer Wirkstoffe beschleunigt wird und neue Produkte in einem kompetitiven Markt die Zulassung und damit die Patienten zeit- und kosteneffektiver erreichen. Dabei handelt es sich um ein Translationsprogramm, das als Fonds (Translationsfonds) eingerichtet werden soll, der gemeinsam von BMBF und Industrie finanziert wird. Aus dem Fonds sollen ausgewählte Projekte zur Entwicklung von potenziellen Wirkstoffen gefördert werden.
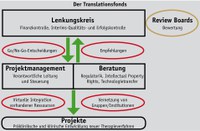
Für den Translationsfonds soll eine umfassende Beratungsstruktur und ein professionelles Projektmanagement aufgebaut werden (s. Abb. zur Fondsorganisation). Durch die strategische Partnerschaft mit der Industrie soll sichergestellt werden, dass geförderte Projekte eine realistische Chance auf eine präklinische Validierung und eine klinische Anwendung haben, konkurrenzfähig sind und vermarktet werden können. Außerdem sollen erfahrene Projektmanager das Aufstellen wichtiger Go/NoGo-Meilensteine gewährleisten sowie schnelle Entscheidungen und eine kompetitive Entwicklung der Wirkstoffkandidaten.
Der Translationsfonds sollte auf bereits vorhandene Einrichtungen und Infrastrukturen zurückgreifen, die translationale Forschung in Deutschland betreiben und die wesentlichen Akteure zusammenbringen. In einem solchen Modell sollen die akademischen Partner von der Unterstützung und Einlizenzierung ihrer Projekte durch die Industrie profitieren und an der Realisierung ihrer Innovationsideen teilhaben. Im Gegenzug zur Beteiligung am Translationsfonds bietet er den beteiligten Unternehmen einen Zugang zu innovativen Ideen und Mitwirkung bei der Projektauswahl. Darüber hinaus sollten beteiligte Firmen das Recht auf Information und eine Option auf den ersten Zugriff erhalten, schreiben die Autoren.
Der Translationsfonds sollte Themenschwerpunkte auf Gebieten mit hohem medizinischem Bedarf in Angriff nehmen wie etwa Antibiotika, Impfstoffe, seltene Erkrankungen, bisher nur schlecht oder sehr teuer therapierbare Erkrankungen. Es sollen aber auch Themenschwerpunkte, die die Industrie weniger intensiv bearbeitet, beziehungsweise Mandate für Pandemiefälle, berücksichtigt werden.
Der Fonds würde ein jährliches Budget von circa 60 Millionen Euro (je zur Hälfte öffentliche und Industriemittel) erfordern, schätzt die Arbeitsgruppe. Aufgrund der langen Entwicklungszeiten von Wirkstoffen sollte der Förderungszeitraum mindestens zehn bis fünfzehn Jahre betragen. Die Projekte sollten regelmäßig meilensteinabhängig überprüft werden und klaren Go-/NoGo-Entscheidungen unterliegen.
Die Steuerung soll beim Translationsfonds durch einen Lenkungskreis erfolgen, der durch Review Boards unterstützt wird (s. Abb.). Kern des vorgeschlagenen Programms ist die professionelle Beratung durch präklinisch und klinisch kompetente Projektmanager mit langjähriger Erfahrung in der Wirkstoffentwicklung, die die Projekte verantwortlich betreuen sollten. Darüber hinaus sollte eine Beratung zu regulatorischen Fragen, zu Intellectual Property Rights (IPR) und zum Technologietransfer die Projekte unterstützen.
Alle Projekte sollten entsprechend ihrer Meilensteinplanung einen engmaschigen Review Prozess durchlaufen. Als zentrale Erfolgskriterien für den Translationsfonds betrachten die Autoren die Anzahl der initiierten klinischen Prüfungen mit erstem Wirksamkeitsnachweis im Menschen, die Anzahl der Projekte, die ihre definierten Meilensteine erreicht haben sowie die Anzahl der industriellen Kooperationen und Lizenzierungen beziehungsweise die Anzahl der Spin-off-Unternehmen.
Zur erfolgreichen Umsetzung des Translationsfonds listet die Arbeitsgruppe vorbereitende und unterstützende Maßnahmen auf:
• Ein Mapping sollte zunächst eine Übersicht zu Infrastrukturen für die verschiedenen Schritte der Arzneimittelentwicklung und deren Nutzungs- und Zugangsbedingungen erstellen, um diese in den Translationsfonds zu integrieren und keine neuen Strukturen aufbauen zu müssen.
• Akademische Projekte sollten in Konsortien mit komplementären Expertisen so weiterentwickelt werden, dass sie Eingang in den Translationsfonds finden können. Hierzu sollten spezifische Fördermaßnahmen für konfirmatorische tierexerimentelle Studien und für Screening-Prozesse aufgelegt werden.
• Darüber hinaus sollten Universitäten in Zusammenarbeit mit industriellen Partnern Postgraduierten-Programme für translationsrelevante Bereichen entwickeln. <<
von:
Olga Gilbers
Zitationshinweis : Gilbers, O.: „Zwei Hürden – zwei Lösungsvorschläge“, in „Monitor Versorgungsforschung“ (05/17), S. 14-16; doi: 10.24945/MVF.05.17.1866-0533.2034