Können anwendungsbegleitende Datenerhebungen überhaupt realisiert werden?
http://doi.org/10.24945/MVF.02.20.1866-0533.2212
>> Mit dem „Gesetz für mehr Sicherheit in der Arzneimittelversorgung“ (GSAV) hat der Gesetzgeber bestimmt, dass Arzneimittel, die zwar am Markt sind, die aber aufgrund vereinfachter Verfahren zugelassen worden sind, auch nach der Zulassung einer weiteren Prüfung unterzogen werden sollen. Sie sollen damit über die Zeit hinweg sukzessive ihren zusätzlichen Nutzen belegen. Die Ergebnisse sollen für Preisverhandlungen zur Verfügung stehen, die in gewissen Abständen wiederholt werden. Konkret kann der G-BA von Herstellern eine Datenerhebung verlangen, ist aber aufgerufen, den Grundsatz der Verhältnismäßigkeit zu beachten.
Mit der Forderung nach anwendungsbegleitenden Datenerhebungen (ABDE) gibt der Gesetzgeber den Weg frei, dass die Nutzenbewertung von Arzneimitteln auch mit Daten erfolgen kann, die nicht mit dem Instrumentarium der klassischen kontrollierten randomisierten Interventionsstudie (RCT) erzeugt worden sind. Damit kommen auch offiziell Daten aus dem Bereich der sog. Real World Evidence (RWE) als Grundlage für Nutzenbewertungen und Preisverhandlungen in Frage. Der Gesetzgeber reagiert damit auf eine sich beschleunigende Dynamik in der Arzneimittelentwicklung, durch die zunehmend kleinere Zielpopulationen adressiert werden, weil diese „Targeted Therapies“ für meist genetisch spezifizierte Zielgruppen entwickelt werden, die naturgemäß eng umschrieben sind. Hinzu kommt, dass die Marktzulassung von Arzneimitteln gegen seltene Krankheiten durch EU-Recht gefördert wird.
Diese Entwicklungen führen dazu, dass die verfügbare Evidenz zum Zeitpunkt der Zulassung häufiger als bisher ergänzungsbedürftig ist. Hohe Marktzugangshürden in Deutschland, die aus diesem Umstand resultieren, bergen die Gefahr, dass es zunehmend zum Verzicht auf eine Markteinführung kommen könnte, wenn die Hersteller sich zurückziehen, weil für Produkte die Evidenz fehlt, die auf Basis von RCTs zu gewinnen wäre. Es könnte dann keine ausreichende Verhandlungsbasis geschaffen und demzufolge kein akzeptabler Preis erzielt werden. Dies könnte sich zum Nachteil für deutsche Patientinnen und Patienten entwickeln.
Vor diesem Hintergrund entwickelte sich weithin die Vorstellung, dass klinische Register das geeignete Vehikel für ABDE sein könnten. Der G-BA hat daher (in der Vorbereitung des GSAV) das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) mit der Ausarbeitung eines Gutachtens zur „Wissenschaftlichen Ausarbeitung von Konzepten zur Generierung versorgungsnaher Daten und deren Auswertung“ beauftragt. Die Ergebnisse dieses Gutachtens stehen nunmehr in Form eines Rapid Reports1 zur Verfügung. Erwartungsgemäß sind hohe methodische Anforderungen an klinische Register formuliert worden, die die Grundlage für darauf aufsetzende Beobachtungsstudien sein sollen. Die methodischen Vorgaben des IQWiG sind vom G-BA weitgehend anerkannt worden. Vor diesem Hintergrund stellt sich die Frage, ob die aktuell bestehende Situation klinischer Register eine Umsetzung der gesetzlichen Vorgaben gewährleisten kann und welche zusätzlichen Entwicklungsschritte ggf. erfolgen müssen, damit dies der Fall sein wird.
Dieser Frage geht eine Untersuchung nach, deren Ergebnisse an dieser Stelle vorab in einer Kurzfassung dargestellt werden. Die Studie soll im aktuell laufenden Prozess der Ausgestaltung Anhaltspunkte dafür geben, inwieweit mittels Registern erzeugte Evidenz in die Nutzenbewertung einbezogen werden kann, wenn die gegenwärtige Leistungsfähigkeit der Register und die vom Gesetzgeber vorgegebene Verhältnismäßigkeit berücksichtigt werden.
Recherche: Register für nur wenige Indikationen
Die prinzipielle Verfügbarkeit von Registern in Deutschland wurde konkret für den zu erwartenden Bedarf ermittelt. Hierzu wurde die Frage gestellt, welche Arzneimittel, die seit Bestehen des AMNOG mit einer vereinfachten Zulassung auf den Markt gekommen sind, für eine ABDE in Frage gekommen wären. In einer Recherche konnten zum Zeitpunkt der Datenabfrage (15.08.2019) insgesamt 80 Humanarzneimittel identifiziert werden, die bis dato das AMNOG-Verfahren durchlaufen haben und auf die die Regelung des GSAV Anwendung gefunden haben könnte. Um einen aktuellen Überblick zu in Deutschland verfügbaren Registern zu erhalten, wurde anhand der Indikationsbereiche der betreffenden Produkte eine Suche über Orphanet sowie Webseiten von relevanten Fachgesellschaften durchgeführt und durch eine Freihandsuche im Internet ergänzt.
Von den insgesamt 80 Produkten wurde für 65 Produkte (81 Prozent) mindestens ein zur Verfügung stehendes Register identifiziert. Bei diesen handelt es sich fast ausnahmslos um Indikationsregister. Für nur ein Präparat
wurde ein Produktregister gefunden. Für 51
der 80 Produkte (64 Prozent) hätte ein Register innerhalb des Bundesgebiets zur Verfügung gestanden, für zehn Arzneimittel ein europäisches und für vier ein globales Register. Darüber hinaus wurde festgestellt, dass von den 65 Arzneimitteln für 21 (26 Prozent) mehr als ein Register zur Verfügung gestanden hätte. Insgesamt konnten für die 65 Produkte 42 Register identifiziert werden.
Die Tatsache, dass für ein Viertel der identifizierten Arzneimittel mehr als ein Register verfügbar ist, ist leider nicht als Vorteil zu werten. In diesen Fällen verteilen sich die gemeldeten Fälle vermutlich auf mehrere Register und können im Sinne der Vollzähligkeit nur genutzt werden, wenn es gelingt, die Daten der verschiedenen Register zusammenzuführen. Aus Praktikabilitätsgründen ist
nicht davon auszugehen, dass Behandler in mehreren Registern dokumentieren, Patienten werden sich nur jeweils einem Register zuordnen. Die potenziell eintretende Fragmentierung der Datenbestände kann das Erreichen hinreichender Fallzahlen in Frage stellen. Ein Datenpooling, das dieses Problem heilen könnte, setzt kompatible Datenformate voraus. Entsprechende Konvergenzbemühungen sind aus einigen Landeskrebsregistern bekannt, befinden sich aber noch am Anfang.
Vor dem Hintergrund dieser Befunde muss unter heutigen Bedingungen davon ausgegangen werden, dass für fast 20 Prozent der Produkte noch kein Register zur Verfügung steht und für ein weiteres Viertel auf absehbare Zeit ebenfalls keine ausreichenden Datenbestände bereitstehen werden.
Kann die Abdeckungsquote noch als relativ günstige Ausgangslage für ABDE betrachtet werden, so entscheidet sich die Leistungsfähigkeit der Registerlandschaft insgesamt an den Leistungsmerkmalen der einzelnen Register.
Umfrage: Gute Ansätze bei Register
Um einen Einblick in den Betrieb, die Leistungsmerkmale und das Entwicklungspotenzial von Registern zu erhalten, wurden halbstandardisierte Interviews mit Registerbetreibern geführt. Diese wurden aus insgesamt 39 der 42 Register ausgewählt, für die ein Ansprechpartner ermittelt werden konnte. Zehn Betreiber waren zu einem Gespräch bereit, drei weitere Betreiber stellten zumindest Daten öffentlich zur Verfügung, die für eine Auswertung ausreichend waren. Die Befragung konzentrierte sich auf folgende Leistungsmerkmale: Vollzähligkeit, Vollständigkeit, Flexibilität (Erweiterbarkeit des Datensatzes), Erhebungsfrequenz und Longitudinalität, Differenziertheit des Datensatzes (darunter insbesondere relevante Confounder und „patient reported outcomes“ PROs), Zugang (Nutzbarkeit der Daten für Interessierte), Timeliness (Dauer von Datenanfrage bis Datenverfügbarkeit) sowie Kosten. Die Auswahl der Merkmale folgte pragmatischen Überlegungen und orientierte sich an der aktuellen methodischen Diskussion zur Qualität von Registern.1
Bei der Ergebnisdarstellung soll zunächst hervorgehoben werden, dass sich über alle Erhebungen hinweg vereinzelt überzeugende Ansätze und zum Teil sehr weit entwickelte Lösungen fanden. Als Beispiele hierfür seien die hochgradige Vollzähligkeit und Vollständigkeit der Erstdokumentation meldepflichtiger Register, die technische Implementierung zur Aufnahme ergänzender Datenfelder sowie ein hoch ausdifferenzierter und auch erweiterbarer Datensatz, der patientenrelevante Outcomes und Daten zur Lebensqualität umfasst, angeführt.
Für die überwiegende Anzahl der befragten Register, wie auch für die lediglich auf Basis öffentlich verfügbarer Daten beurteilten Register gilt allerdings auch, dass Merkmale identifiziert wurden, die mit einer hinreichenden Datenqualität nicht kompatibel sind. Dies betrifft eine lückenhafte und in großen und unregelmäßigen Zeitabständen erfolgende Dokumentation, die mangelnde oder fehlende Berücksichtigung von Confoundern und die weitgehend ausbleibende Qualitätssicherung durch ein Monitoring. Auch in vergleichsweise weit entwickelten Registern finden sich überwiegend keine Daten zur Lebensqualität. Weitere Probleme, die von Interviewpartnern vorgetragen wurden, sind die große, meldestellenabhängige Varianz, der Abbruch der Dokumentation bei Wechsel des Behandlers und das Fehlen von Daten aus dem ambulanten Bereich. Die Bereitschaft zur Anpassung der Datensätze an konkrete Vorhaben zur ABDE ist nicht immer vorhanden.
Lediglich ein Register „ready-to-use“
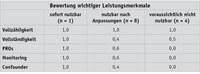
Für die einbezogenen 13 Register wird nachfolgend zusammengetragen, inwieweit wichtige Leistungsmerkmale vorhanden sind. Die Ergebnisse sind in Tabelle 1 zusammengefasst.
Anhand der erhobenen Befunde wurden die Register drei Kategorien zugeordnet:
• „ready-to-use“ („alle kritischen Merkmale sind abgedeckt“)
• Eingeschränkt nutzbar, z. T. erhebliche Anpassungen des Registerbetriebes erforderlich
• Register auf absehbare Zeit voraussichtlich nicht nutzbar / Ausprägung des Leistungsmerkmals nicht vorhanden
Lediglich bei einem Register konnte für alle Merkmale eine positive Ausprägung festgestellt werden. Acht der 13 Register wurden der Kategorie „eingeschränkt nutzbar“ zugeordnet. Für diese Register zeigen sich zwar negative Ausprägungen von kritischen Merkmalen (z. B. keine Erfassung von Confoundern, mangelnde Vollständigkeit), die Bereitschaft der Betreiber, Anpassungen vorzunehmen, ist jedoch vorhanden und deren Umsetzung wird als realistisch eingeschätzt. Für vier Register zeigen sich große Defizite, die Bereitschaft zu Anpassungen im Sinne einer Nutzbarkeit für ABDEs wird zudem vor dem Hintergrund eines zu hohen Aufwands abgelehnt. Von den Leistungsmerkmalen sind insbesondere die Implementierung von PROs und Confoundern sowie eines Monitorings am schwächsten ausgeprägt.
Insgesamt zeigt sich, dass mit Ausnahme eines Registers derzeit kein bestehendes Register geeignet ist, ohne Verzug ABDEs in guter Qualität zu realisieren oder gar die vom IQWiG gestellten Anforderungen zu erfüllen.
Zwar ist die Anpassungsfähigkeit einiger Register sehr begrenzt, es wird jedoch auch deutlich, dass die Registerlandschaft vielversprechende Ansätze bietet. Ein Austausch der Registerbetreiber über die Realisierungsbedingungen positiver Merkmale könnte die Entwicklung der Registerlandschaft erheblich beschleunigen.
Unerfüllbare IQWiG-Anforderungen an Confounder-Kontrolle
Wie die Sichtung von verfügbaren Datensatzstrukturen und die Befragung ergaben, sind Confounder in den Registern überwiegend nicht oder nur unzureichend abgebildet. Selbst wenn die Datensätze mittelfristig entsprechend erweitert werden könnten, ist nicht davon auszugehen, dass zum Zeitpunkt der Datenauswertung alle dann bekannten Confounder in die Analysen einfließen können. In Indikationen mit intensiver Forschungstätigkeit – und um solche handelt es sich im GSAV-Kontext – kommt es häufig zu neuen Erkenntnissen hinsichtlich relevanter prognostischer Faktoren und damit zur Ergänzung bereits bekannter Confounder. Die Aufnahme dieser Confounder in Register wird daher immer einen zeitlichen Versatz aufweisen. Darüber hinaus muss berücksichtigt werden, dass in Registern regelhaft nur solche Merkmale abgebildet werden können, die gemäß der zum Behandlungszeitpunkt geltenden Leitlinien in der Versorgungspraxis erhoben werden. Vor diesem Hintergrund ist die im Rapid Report empfohlene grundsätzliche Ablehnung von Evidenz aus versorgungsnahen Daten bei unvollständiger Confounder-Kontrolle sehr problematisch. Eine regelhafte Ablehnung der vorgelegten Evidenz aus Registerstudien wäre auch bei sorgfältiger und frühzeitiger Planung voraussichtlich die Folge.
Grundsatz der Verhältnismäßigkeit wahren
Im Rahmen der Befragung wurden zum Teil zweistellige Millionenbeträge für den Aufbau eines Registers genannt. Einstellige Millionenbeträge können jährlich für den Un-
terhalt eines Registers erforderlich sein. Es ist zu beachten, dass die Umsätze vieler
Orphan Drugs im unteren einstelligen
Millionenbereich pro Jahr liegen. Für diese Fälle wird sich die Frage stellen, ob die Kosten für die Umsetzung sehr hoher Qualitätsanforderungen in Registern noch dem Gebot der Verhältnismäßigkeit entsprechen. Es wurde in der Befragung deutlich, dass die in Zukunft sicherlich erforderlichen Geschäftsmodelle zur Finanzierung von Registerstrukturen und deren Entwicklung bisher noch wenig ausgereift sind. Offen ist auch die Frage, wie Vorhaltekosten von Kosten für Registerstudien voneinander zu trennen sind. Grundsätzlich ist zu empfehlen, dass offene Finanzierungsfragen bei Fristsetzungen für ABDE Berücksichtigung finden.
Zusammenfassung
Die Registerlandschaft in Deutschland ist in den vom GSAV adressierten Indikationen mit relativ guter Abdeckung angelegt. Es lassen sich eine Vielzahl von positiven Merkmalen der bestehenden Register finden. Allerdings sind die bestehenden Register – mit wenigen Ausnahmen – auf Grund von Defiziten, die die Aussagekraft von Registerstudien beeinträchtigen, zum jetzigen Zeitpunkt nicht in der Lage, ohne Verzug ABDEs in guter Qualität zu realisieren oder gar die vom IQWiG gestellten Anforderungen zu erfüllen. Darin liegt ein Risiko für die Realisierung der vom Gesetzgeber intendierten Nutzung von RWE. Die Weiterentwicklung der Registerlandschaft kann nur schrittweise erfolgen und sollte durch Konsens zur Beurteilung der Qualität von Registern gefördert werden. Methodische Anforderungen an Registerstudien sollten die aktuelle Leistungsfähigkeit von Registern und finanzielle Aufwände des Betriebes von Registern berücksichtigen, um die gewünschte Entwicklung von ABDE nicht durch unverhältnismäßige Anforderungen an die Beteiligten zu behindern. <<
Autoren:
Fabian Berkemeier, Leiter des Bereichs Value & Access Strategy am IGES Institut
Dr. Holger Gothe, Leiter des Bereichs Versorgungsforschung am IGES Institut
Dr. Marc Kurepkat, Geschäftsführer CSG Clinische Studien Gesellschaft mbH
Zitationshinweis:
Berkemeier, F., Gothe, H., Kurepkat, M.: „Können anwendungsbegleitende Datenerhebungen überhaupt realisiert werden?“, in „Monitor Versorgungsforschung“ (02/20),
S. 41-43, doi: 10.24945/MVF.02.20.1866-0533.2212
Literatur
1. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen – IQWiG (Hrsg.): Versorgungsnahe Daten zum Zwecke der Nutzenbewertung. Rapid Report A19-43, Version 1.0 vom 10.01.2020. Köln: IQWiG, https://www.iqwig.de/download/A19-43_Versorgungsnahe-Daten-zum-Zwecke-der-Nutzenbewertung_Rapid-Report_V1-0.pdf [Zugriff 12.03.2020]
2. Gliklich R, Dreyer N, Leavy M (Hrsg.): Registries for Evaluating Patient Outcomes: A User’s Guide. Third edition. AHRQ Publication No. 13(14)-EHC111. Rockville, MD: Agency for Healthcare Research and Quality, 2014. http://www.effectivehealthcare.ahrq.gov/registries-guide-3.cfm [Zugriff 12.03.2020]
3. European Medicines Agency, The Cross-Committee Task Force on Patient Registries: European Medicines Agency Discussion paper: Use of patient disease registries for regulatory purposes – methodological and operational considerations. EMA/763513/2018, 05.11.2018. https://www.ema.europa.eu/documents/other/discussion-paper-use-patient-disease-registries-regulatory-purposes-methodological-operational_en.docx [Zugriff: 12.03.2020]
4. European Network for Health Technology Assessment: REQueST (Registry Evaluation and Quality Standards Tool). 30.09.2019. https://eunethta.eu/wp-content/uploads/2019/10/Registry-Evaluation-and-Quality-Standards-Tool-REQueST-1.xlsm. [Zugriff 12.03.2020]
5. Stausberg J, Maier B, Bestehorn K, Gothe H et. al.: Memorandum Register für die Versorgungsforschung: Update 2019. Gesundheitswesen 2020 Feb 18. DOI: 10.1055/a-1083-6417. [Epub ahead of print]