10 Jahre AMNOG: die regionale Perspektive
http://doi.org/10.24945/MVF.01.21.1866-0533.2278
>> Maria Huber, Krebspatientin in Mecklenburg-Vorpommern, versteht ihren behandelnden Onkologen nicht. Seit einigen Monaten ist sie mit ihrer lebensbedrohlichen Erkrankung, dem kutanen Plattenepithelkarzinom (cSCC), bei ihm in Behandlung – mit großem Erfolg. Sie erhält ein neues Produkt, Cemiplimab, das ihrem Immunsystem wieder die Möglichkeit gibt, die Krebszellen in ihrem Körper zu erkennen und selbst zu zerstören. Seit kurzer Zeit heilen die Hautläsionen, sie versteckt sich nicht mehr zuhause und geht wieder in die Öffentlichkeit. Heute erfährt sie von ihrem Arzt, dass eine nationale Nutzenbewertung festgestellt habe, dass ihre neue Therapie, die sie vom in Kürze zu erwartenden Tod zurück ins Leben bringt, keinen Zusatznutzen habe gegenüber einer rein palliativen Sterbebegleitung. Wie können Experten zu einer solchen Stellungnahme kommen und neugewonnenes Leben und ihre neue Lebensperspektive geradezu missachten?
Findet sich das individuelle Patientenschicksal einer Maria Huber daher tendenziell in den Berichten zum AMNOG-Geburtstag oder sind es die nationalen Stellungnahmen des G-BA, zum Beispiel von Prof. Josef Hecken, dem unabhängigen Vorsitzenden des G-BA, zum Jubiläum, oder sind darüber hinaus weitere Aspekte für die Umsetzung von AMNOG-Bewertungen relevant im Rahmen eines regionalen Blitzlichts zum 10-jährigen Geburtstag des AMNOG?
Im UCEF-Workshop fanden die Teilnehmer schnell einen Konsens zu positiven Effekten des AMNOG. Bejahende Zustimmungen gab es vor allem zu den folgenden Aspekten:
(1) Es wurde ein transparentes, allgemein akzeptiertes und anpassungsfähiges Verfahren etabliert.
(2) In den Bewertungen findet man alle relevanten Informationen aus den z. T. unveröffentlichten Studien zu dem jeweiligen Wirkstoff.
(3) Der Marktzugang neuer Arzneimittel wurde nicht behindert.
(4) Durch die vereinbarten Erstattungsbeträge konnten inzwischen substanzielle Einsparungen erzielt werden.
Trotz der letztgenannten positiven Erfahrungen wurde seitens der Vertreter aus dem Bereich der Krankenkassen darauf hingewiesen, dass die Arzneimittelausgaben auch unter dem AMNOG in den vergangenen Jahren erheblich gestiegen seien. Gründe für diese Steigerung seien neben der Morbiditätsstruktur der Versicherten vor allem Innovationen und damit einhergehende Preiseffekte.
So würden die im AMNOG erzielten Preisreduzierungen der Ausgabensteigerung z. B. aus den Bereichen von Immunologie und Onkologie zwar entgegenwirken, die erzielten Einspareffekte wären jedoch ausbaufähig. Möglichkeiten hierzu wären z. B. eine Orientierung an einem „Pay for performance“ oder Re-Evaluationen auf Basis neuerer Studiendaten. Die vom G-BA erzielten jährlichen Einsparungen der Arzneimittelkosten in Höhe von zuletzt durchschnittlich 3 Mrd. Euro lassen sich aus dieser rein monetären Kostenperspektive weiterhin steigern (Quelle der Einsparungen: Schreiben Prof. Josef Hecken, G-BA vom 14.9.2020).
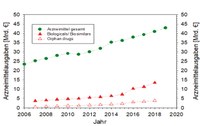
Der sich trotz der Arzneimittelbewertungen fortgesetzte Anstieg der Ausgaben für Arzneimittel spiegelt sich auch in den Therapiegebieten sowie dem Orphan-Drug-Status wider. So betrafen von den 581 Nutzenbewertungsverfahren 233 Arzneimittel für onkologische Erkrankungen und 106 für Stoffwechselerkrankungen. Für diese beiden Therapiegebiete lag auch der Anteil der Orphan Drugs mit 71 bzw. 47 Verfahren recht hoch. Deshalb erfüllt das AMNOG zwar seine Funktion als Kostendämpfungsgesetz, wird aber die vor allem überproportionalen Steigerungen des Anteils der in der Regel teureren Biologicals/Biosimilars und Orphan drugs an den Arzneimittelkosten nicht verhindern können (Abb. 1).
Maria Huber, die Krebspatientin in Mecklenburg-Vorpommern, kann diese Perspektive der Krankenkassen verstehen, aber nicht nachvollziehen. Für sie stellt sich vielmehr die Frage, welche Verantwortung Kostenträger für die Therapie ihrer Erkrankung übernehmen. Wie kann es sein, dass die für sie erfolgreiche Therapie keinen Zusatznutzen hat? Die Nachfrage bei ihrem Arzt ergibt folgende Information: Ihrem Therapeutikum Cemiplimab wurde aus formalen Gründen kein Zusatznutzen zugesprochen. So hatte der G-BA in seiner Bewertung am 6.2.2020 festgestellt, dass er den Zusatznutzen anhand der vorliegenden Daten nicht bewerten könne. Aus diesem Grund sei der Zusatznutzen nicht belegt. Frau Huber stellt fest, dass ihre Therapie und vor allem ihr Therapieerfolg für die Datenanalyse im AMNOG offenbar nicht relevant sind. Die Frage nach der vom G-BA formulierten Verantwortung für Patientinnen und Patienten, erscheint ihr – für sich selbst – unbeantwortet.
Die Situation von Frau Huber ist nach Sachstand der Diskussionsteilnehmer genereller Natur. So stellt der BDI (Bundesverband der Industrie) in der Studie AMNOG-Daten 2020 fest, dass für die Mehrzahl der Nutzenbewertungen im AMNOG in den Jahren 2011 bis 2019 ein Zusatznutzen aus formalen Gründen nicht festgestellt wurde. Die zu bewertenden Daten waren – wie die folgende Abbildung 2 zeigt – entweder nicht ausreichend oder nicht geeignet.
Der BDI stellt in seiner Analyse weiterhin fest, dass ein aus formalen Gründen fehlender Zusatznutzen nicht damit gleichzusetzen sei, dass die entsprechenden Präparate tatsächlich nicht doch einen Zusatznutzen haben. Die Teilnehmer im UCEF-Workshop machten sich diese Perspektive ebenfalls zu eigen. Forderungen aus der Diskussion waren, Nutzenbewertungen im Falle fehlender formaler Datenanforderungen zu befristen und Herstellern die generelle Möglichkeit zu geben oder gar zu fordern, mit neuen bzw. weiteren Daten eine erneute Nutzenbewertung zu initiieren. Ein Schritt in die richtige Richtung ist die Möglichkeit der anwendungsbegleitenden Datenerhebung. Dazu müsste allerdings auch die Pharmaindustrie nach Einschätzung der Kassenvertreter durch Anträge zur Einrichtung von entsprechenden Registern im Vorfeld der Zulassung beitragen, um diesen Prozess eventuell auch mit begleitenden klinischen Studien mit der Zulassung starten zu können. Dadurch lassen sich neue Erkenntnisse im medizinischen Umfeld einer Therapie oder auch Entwicklungen im Bereich von Leitlinien berücksichtigen.
Ein weiterer Diskussionspunkt widmete sich der Frage, wie positive Nutzenbewertungen in ihrer Umsetzung durch den verordnenden Arzt zu betrachten sind. Erreichen diese Bewertungen die Ärzte und können sie gemäß den AMNOG-Ergebnissen direkt an die Patienten weitergegeben werden, ohne dass Ärzte Angst vor Regressen haben müssen?
Zu dieser Frage stellte das IGES Institut im Jahr 2017 im Rahmen einer empirischen Analyse bereits fest, dass die Marktdurchdringung neuer Wirkstoffe in Deutschland generell gering ist. Danach erreichen neue Wirkstoffe mit oder ohne Nutzenbewertung innerhalb von zwei Jahren generell selten mehr als zehn Prozent ihres erwarteten Verbrauchs bei der betroffenen Patientengruppe, ein positiver Zusatznutzen gehe nicht zwangsläufig mit einem Mehrverbrauch einher. Eigene Erfahrungsberichte aus Pharmaindustrie und Ärzteschaft am Beispiel neuer Antikörper im Bereich der Immunmodulation bestätigten das IGES-Gutachten. So z.B. im Falle des Antikörpers Dupilumab bei der Behandlung von „Chronischer Rhinusitis mit Nasenpolypen“, einer Erkrankung im Verantwortungsbereich von Hals-Nasen-Ohren-Ärzten. Der G-BA hat für das Produkt in der gerade genannten Indikation im AMNOG-Verfahren einen Beleg für einen beträchtlichen Zusatznutzen ausgesprochen (G-BA-Beschluss vom 14.5.2020). Diese Bewertung trifft bei HNO-Ärzten in vielen Regionen auf die Situation von eher geringen Verordnungsvolumina gemäß den dortigen Arzneimittelvereinbarungen. HNO-Ärzte überschreiten bei der Verordnung von Antikörpern wie z.B. Dupilumab ihre spezifischen Verordnungsvolumina und werden „auffällig“. Diesem Thema widmete sich bereits ein Gutachten der Universität Duisburg-Essen (Professor Wasem und Mitarbeiter). Die Experten stellten dort einen Regulationskonflikt zwischen den Wirtschaftlichkeitskonzepten AMNOG versus regionaler Arzneimittelvereinbarung fest (s. Abb. 3).
In ihrer regulatorischen Analyse kamen sie zur Schlussfolgerung:
„Es bedarf keiner weitergehenden Analyse mehr, um festzustellen, dass die beschriebenen Konzeptionen einer Wirtschaftlichkeit in einer Vielzahl konkreter Fälle miteinander unvereinbar sind. … gleichwohl ist der einzelne Arzt in seiner täglichen Praxis mit beiden, jeweils rechtsgültigen Konzeptionen konfrontiert, so dass er in das persönliche Dilemma kommen kann, nicht gleichzeitig beiden … Sichtweisen Rechnung tragen zu können … Eine effiziente und evidenzbasierte Versorgung der Patienten und eine faktische Bedeutung der Regulierung für den Innovationsanreiz setzen allerdings voraus, dass sich die Ergebnisse der Nutzenbewertung im ärztlichen Versorgungsverhalten tatsächlich in der ursprünglich intendierten Weise niederschlagen.“
Die Umsetzung von AMNOG-Ergebnissen in der Verordnungspraxis kann daher dann gemäß dem Zusatznutzen erfolgen, wenn die Ärzte diesen kennen … und wissen, dass diese keine Konflikte mit regionalen Arzneimittelvereinbarungen haben und sie daher auch keine Angst vor Prüfungen bzw. Regressen haben müssen. Hier bedarf es aus Sicht der Teilnehmer kommunikativer Umsetzungshilfen für das AMNOG: Die Deutungshoheit des G-BA für die AMNOG-Bewertungen gegenüber regionalen Arzneimittelregelungen sei vor allem den niedergelassenen Ärzten stärker zu kommunizieren. Denn letztendlich sind es die Ärzte, die mit der Verschreibung von Arzneimitteln über die Ausgaben dafür entscheiden, wie hoch diese tatsächlich sind.
Aus diesem Grund ist es doch etwas verwunderlich, dass erst ab dem 1. Oktober 2020 in den Programmen der Praxisverwaltungssoftware die Ergebnisse der Nutzenbewertung durch den G-BA angezeigt werden. So soll das Ausmaß des Zusatznutzens eines Wirkstoffes mittels grafischer Elemente und unter Zuordnung zu ICD10 GM-Diagnosen angezeigt werden. Allerdings wurden vom Gesetzgeber kaum Vorgaben gemacht, welche Informationen wo, wie und mit wie viel Klicks abrufbar sein sollen. Deshalb wird die Umsetzung durch die verschiedenen Softwareprogramme höchst unterschiedlich ausfallen. Bleibt zu hoffen, dass diese Implementierung der AMNOG-Bewertung zu einer schnelleren Durchdringung der neuen Arzneimittel mit einer positiven Zusatznutzenbewertung führt.
Auf die Situation von Orphan Drugs wurde bereits hingewiesen. Bei diesen Präparaten und den meisten anderen Arzneimitteln für onkologische Erkrankungen erfolgt die Erstverordnung der Medikamente oft durch Klinikärzte. Bei einer ambulanten Weiterbehandlung der Patienten kann sich für den niedergelassenen Arzt nicht nur ein Dilemma aufgrund der regionalen Arzneimittelvereinbarung ergeben, wie bereits beschrieben. Und bei vielen Präparaten (ca. 60%) würde angezeigt, dass ein Zusatznutzen nicht belegt sei (siehe oben).
Soll der niedergelassene Arzt nun ein Medikament, welches laut der Anzeige
seiner PVS keinen Zusatznutzen laut des G-BA-Beschlusses belegen konnte und wahrscheinlich teuer ist, deshalb nicht verschreiben, oder die Therapie wie vom Klinikarzt begonnen, fortsetzen? Hier zeigt sich, dass gleiche Maßstäbe für die Verschreibung von Arzneimitteln sowohl für Klinikärzte als auch niedergelassene Ärzte gelten sollten.
Die in der Diskussion genannten Ansätze beinhalteten insgesamt keine grundsätzliche Kritik am AMNOG, sondern Ansatzpunkte für Detailverbesserungen. Das AMNOG habe seine im Jahr 2010 genannten Ziele erreicht, dass „den Menschen im Krankheitsfall die besten und wirksamsten Arzneimittel zur Verfügung stehen müssen, die Preise und Verordnungen von Arzneimitteln wirtschaftlich und kosteneffizient sein müssen und es verlässliche Rahmenbedingungen für Innovationen, die Versorgung der Versicherten und die Sicherung von Arbeitsplätzen geben muss“ (aus: Bundestagsdrucksache 17/2413 Gesetzentwurf der Fraktionen CDU/CSU und FDP 06.07.2010). Allerdings soll das generelle Ziel der Patientenorientierung insgesamt noch stärker im Fokus aller Bewertungen sein. Davon würden Patienten wie Maria Huber, die Krebspatientin in Mecklenburg-Vorpommern, sehr profitieren. <<
von: Dr. Günter Jost (1) und Dr. Thomas Kehl (2)
1 = Unabhängiges Centrum für empirische Markt- und Sozialforschung GmbH (UCEF); 2 = Sanofi
Zitationshinweis:
Jost, G., Kehl, T.: „10 Jahre AMNOG: die regionale Perspektive“, in: „Monitor Versorgungsforschung“ (01/21), S. 35-37; http://doi.org/10.24945/MVF.01.21.1866-0533.2278
Literatur
BARMER Arzneimittelreport 2020, Schriftenreihe zur Gesundheitsanalyse – Band 23, Berlin 2020
Bauer, Cosima; May, Uwe; Wasem, Jürgen, Analyse und Beschreibung des AMNOG Umsetzungsproblems in die Versorgungspraxis, IBES Diskussionsbeitrag, No. 216 (2016), Working Paper, http://hdl.handle.net/10419/125804
BPI – Bundesverband der pharmazeutischen Industrie, AMNOG-Daten 2020
https://www.gkv-gamsi.de/gamsi_berichte/quartalsberichte.jsp
de Millas, Christoph; Höer, Ariane; Zimmermann, Anne; Häussler, Bertram, Marktdurchdringung von neuen Arzneimitteln, Gesundheitsökonomie & Qualitätsmanagement 2017, 22: 150–158
Schwabe, Ulrich; Paffrath, Dieter; Ludwig, Wolf-Dieter; Klauber, Jürgen (Herausgeber), Arzneimittelverordnungs-Report 2019, Springer, Berlin 2019
Schwabe, Ulrich; Ludwig, Wolf-Dieter (Herausgeber), Arzneimittelverordnungs-Report 2020, Springer, Berlin 2020
Storm, Andreas (Herausgeber), AMNOG-Report 2020, Beiträge zur Gesundheitsökonomie und Versorgungsforschung (Band 32) Bielefeld & Hamburg, 2020